饱和溶液和不饱和溶液相互转变的方法 知识点题库
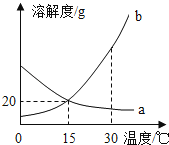
a、b、c三种物质的溶解度曲线如图所示。下列说法正确的是( )
如图为甲、乙、丙三种物质的溶解度曲线.
(1)图中A点表示的乙溶液为(填“饱和”或“不饱和”)溶液;
(2)t3℃时,将40g甲物质加入到50g水中,所得溶液溶质质量分数为 ;
(3)t3℃时,将等质量甲和丙的饱和溶液降温到t2℃,所得溶液质量大小关系为:甲丙(填“<”、“>”或“=”);
(4)将t1℃时丙的不饱和溶液变为饱和溶液可采取的方法为(填一种即可).

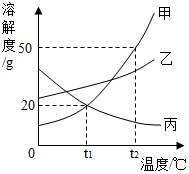
如图是甲、乙、丙三种固体物质的溶解度曲线,请据图回答下列问题.

-
(1) t2℃时甲、乙、丙三种物质的溶解度由小到大的顺序是;
-
(2) P点的含义是;
-
(3) 若甲中混有少量乙,提纯甲的方法是;
-
(4) 将t2℃时甲、乙、丙三种物质的饱和溶液都降温到t1℃,所得溶液中溶质的质量分数由大到小的顺序是;
-
(5) 将甲的不饱和溶液变为饱和溶液,下列说法中正确的是 .A . 溶剂的质量一定变小 B . 溶质的质量可能不变 C . 溶液的质量一定变大 D . 溶质的质量分数一定变大.
 加热一定质量的高锰酸钾固体
B .
加热一定质量的高锰酸钾固体
B .  向一定量的稀硫酸中滴加氢氧化钠溶液至过量
C .
向一定量的稀硫酸中滴加氢氧化钠溶液至过量
C .  一定温度下,向不饱和硝酸钠溶液中不断加入硝酸钠固体,充分搅拌
D .
一定温度下,向不饱和硝酸钠溶液中不断加入硝酸钠固体,充分搅拌
D .  分别向同质量、同质量分数的稀盐酸中不断加入碳酸镁和氧化镁固体
分别向同质量、同质量分数的稀盐酸中不断加入碳酸镁和氧化镁固体
 某温度下,向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体
B .
某温度下,向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体
B .  将稀H2SO4滴入一定量的BaCl2溶液中
C .
将稀H2SO4滴入一定量的BaCl2溶液中
C .  将一定质量的氯酸钾和二氧化锰放入试管中充分加热
D .
将一定质量的氯酸钾和二氧化锰放入试管中充分加热
D .  向pH=13的NaOH溶液中加水稀释
向pH=13的NaOH溶液中加水稀释



-
(1) 写出图中P点的意义。
-
(2) 要使t1℃的C的接近饱和的溶液变为饱和溶液,可采用的方法是。
①升高温度 ②降低温度 ③加入C ④蒸发水
-
(3) t2℃时,将溶液质量相等的A、B、C的饱和溶液分别蒸发10g水,所得溶液的质量从大到小的关系是。
-
(4) 将溶液质量为300g的A的饱和溶液由t2℃降温到t1℃,析出的晶体的质量为。
图1  图2
图2 
-
(1) 你认为烧杯中的溶液可能是不饱和溶液。
-
(2) 如图2是甲、乙两种物质的溶解度曲线图,据图分析,10 ℃时A烧杯和C烧杯中未溶解的溶质质量关系是(填“相等”或“不相等”)。其他条件不变,将C烧杯中的温度升到30 ℃时,C烧杯中的溶液是(填“饱和”或“不饱和”)溶液。
若将A烧杯中的溶质全部溶解,可采用的方法有:①,②。
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
|
溶解度 |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
|
(g/100g水) |
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
①氯化钠的溶解度受温度变化的影响(填“很大”或“很小”)。
②50℃时,KNO3的溶解度(填“<”、“>”或“=”)NaCl的溶解度;向烧杯中加入100g水和49.0gKNO3固体配成50℃的溶液,再冷却到20℃,烧杯中析出固体的质量为g。
③KNO3中混有少量的NaCl,提纯的方法是(填“降温结晶”或“蒸发结晶”)。
④要比较NaCl和KNO3在水中的溶解性强弱,测定的数据可以是:相同温度下,等质量的溶质完全溶解达到饱和时所需水的质量;或。
⑤如图是有关硝酸钾溶液的实验操作及变化情况,说法正确的是(填编号)。

A 操作I一定是降温
B a与b的溶剂质量可能相等
C a与c的溶质质量一定相等
D b与c的溶质质量分数一定相等
|
温度/℃ |
20 |
40 |
60 |
|
|
溶解度 |
NaCl |
36.0 |
36.6 |
37.3 |
|
KNO3 |
31.6 |
63.9 |
110 |
|
-
(1) 60℃,100g水中最多能溶解KNO3的质量为。
-
(2) 下列说法正确的是_____(填序号)A . 20℃时,KNO3饱和溶液的质量分数为31.6% B . 40℃时,136.6gNaCl溶液中一定含有36.6gNaCl C . 将40℃时KNO3的饱和溶液降温到20℃,析出32.3gKNO3固体 D . 将40℃时NaCl和KNO3的饱和溶液分别降温至20℃,降温后两溶液质量分数的大小关系为NaCl>KNO3
-
(3) 20℃时,按下列图示操作:

①在溶液A,B,C中,KNO3溶解达到饱和状态的有(填字母)
②比较溶液A、B中KNO3的质量分数:AB(填“>“或”<”或“=”)
 在密闭锥形瓶内点燃红磷
B .
在密闭锥形瓶内点燃红磷
B .  加热一定量的高锰酸钾固体
C .
加热一定量的高锰酸钾固体
C .  电解水
D .
电解水
D .  饱和的氯化钠溶液恒温蒸发水
饱和的氯化钠溶液恒温蒸发水
 为 20℃时,向接近饱和的硝酸钾溶液中加入硝酸钾固体,溶液质量的变化
B .
为 20℃时,向接近饱和的硝酸钾溶液中加入硝酸钾固体,溶液质量的变化
B .  为在稀硫酸中不断加水时,溶液 pH 的变化
C .
为在稀硫酸中不断加水时,溶液 pH 的变化
C .  为密闭容器中等质量的硫和氧气燃烧过程中部分物质的质量变化
D .
为密闭容器中等质量的硫和氧气燃烧过程中部分物质的质量变化
D .  为等质量的镁、锌分别与足量的相同溶质质量分数的稀盐酸反应,生成盐的质量变化
为等质量的镁、锌分别与足量的相同溶质质量分数的稀盐酸反应,生成盐的质量变化



