用水稀释改变浓度的方法 知识点题库
实验室用密度为1.84g/cm3、质量分数为98%的浓硫酸和蒸馏水,配制500g质量分数为20%的稀硫酸。需要用多少mL的量筒量取多少mL的浓硫酸( )
A . 100mL 54.35mL
B . 100mL 55.5mL
C . 250mL 54.35mL
D . 250mL 55.5mL
下列图象一定不能正确反映其对应关系的是( )
A . 某温度下,向一定量的氯化钠溶液中不断加入水 B . 向一定量的氢氧化钠和氯化钠的混合溶液中逐滴加入氯化铁溶液
B . 向一定量的氢氧化钠和氯化钠的混合溶液中逐滴加入氯化铁溶液 C . 向一定量的氢氧化钠溶液中逐滴加水稀释
C . 向一定量的氢氧化钠溶液中逐滴加水稀释 D . 向两个分别盛有质量相等的氢氧化镁和氧化镁固体的烧杯中,逐滴加入溶质质量分数相同的稀盐酸
D . 向两个分别盛有质量相等的氢氧化镁和氧化镁固体的烧杯中,逐滴加入溶质质量分数相同的稀盐酸
 B . 向一定量的氢氧化钠和氯化钠的混合溶液中逐滴加入氯化铁溶液
B . 向一定量的氢氧化钠和氯化钠的混合溶液中逐滴加入氯化铁溶液 C . 向一定量的氢氧化钠溶液中逐滴加水稀释
C . 向一定量的氢氧化钠溶液中逐滴加水稀释 D . 向两个分别盛有质量相等的氢氧化镁和氧化镁固体的烧杯中,逐滴加入溶质质量分数相同的稀盐酸
D . 向两个分别盛有质量相等的氢氧化镁和氧化镁固体的烧杯中,逐滴加入溶质质量分数相同的稀盐酸
金属和溶液在生产、生活中应用广泛
(1)工业上用磁铁矿炼铁的原理为 ,其中高炉内加入焦炭的作用是 .
(2)农业生产中常用15%的食盐水来选种,现有50g质量分数为25%的氯化钠溶液,欲稀释为质量分数为15%的氯化钠溶液,需要加入水的质量为 .
某注射用药液的配制方法如下
(1)把1.0g药品溶于水配制成5.0mL溶液a;
(2)取0.1mL溶液a,加水稀释至1.0mL,得溶液b;
(3)取0.1mL溶液b,加水稀释至1.0mL,得溶液c;
(4)取0.2mL溶液c,加水稀释至1.0mL,得溶液d;
在整个配制过程中药液很稀,其密度可近似看做1g/cm3 , 则1.0g药品一共可配制溶液d的体积是( )
A . 000mL
B . 2500mL
C . 250mL
D . 1000mL
化学知识中有很多的“相等”.请判断下列说法不正确的是( )
A . 溶液稀释前后,溶质的质量相等
B . 化合物中元素化合价的正价总数与负价总数的数值相等
C . 50mL水和50mL酒精混合后,所得溶液体积等于100mL
D . 溶液中阳离子所带正电荷总数与阴离子所带负电荷总数相等
化学中有许多“相等”,下列有关“相等”的说法错误的是( )
A . 溶液加水稀释前后溶质的质量一定相等
B . 化合物中化合价的正价总数与负价总数一定相等
C . 酒精和水混合前总体积之和与混合后的总体积一定相等
D . 参加反应的各物质质量总和与生成的各物质质量总和一定相等
水和空气是人类赖以生存的自然资源.
-
(1) 下列有关水和空气的叙述中正确的是 .A . 地球上水的总储量很大,但淡水资源并不充裕 B . 充分利用太阳能、氢能等清洁能源可减少酸雨、温室效应等环境问题的发生 C . 目前计入空气质量日报的主要污染物中已包括了二氧化碳 D . 空气是重要的自然资源,利用其成分可以制造许多产品
-
(2) 溶解了较多的可溶性钙和镁的化合物的水属于硬水,实验室中一般可用的方法来降低水的硬度.
-
(3) 实验室欲将200g质量分数为10%的氯化钠溶液稀释为5%的稀溶液,需加水的质量为.
0.2%~0.5%的过氧乙酸(CH3COOOH)溶液是一种杀菌能力强的高效消毒剂.
-
(1) 过氧乙酸分子中 C、H、O 原子个数比为;
-
(2) 过氧乙酸中元素质量分数最大为;
-
(3) 欲配置 0.4%的过氧乙酸溶液 1000g,需用 20%的过氧乙酸溶液 g.
酸碱盐是初中化学重要的化合物
-
(1) 将①浓盐酸②浓硫酸③NaOH溶液④Ca(OH)2溶液⑤NaCl溶液分别敞口放置在空气中,一段时间后,溶液质量增加的是.(填序号)
-
(2) 欲将50g溶质质量分数为98%的浓硫酸稀释成溶质质量分数为19.6%的稀硫酸,需要加水g,请简述稀释浓硫酸的正确操作.
-
(3) 用NaOH固体配置50g质量分数为10%的NaOH溶液来制作“叶脉书签”,所需的玻璃仪器有,量取水时若仰视读数,会使制得的溶液中溶质的质量分数(填“偏大”、“偏小”或“不变”)
-
(4) 向氢氧化钠溶液中不断滴入盐酸,得到如图曲线,a点时溶液中的溶质是,c点时向溶液中加入紫色石蕊溶液呈色.
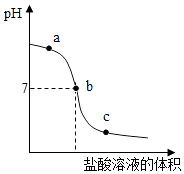
-
(5) 使用纯碱中常含有少量的氯化钠,现取某使用纯碱样品2.5g,加水溶解,配成溶液,向其中加入一定量CaCl2溶液恰好完全反应,同时产生了2g沉淀.试计算该食用纯碱中Na2CO3的质量分数(写出计算过程).
氧气、水是我们身边重要的物质.
-
(1) A、B、C都是研究物质组成和性质的实验.

①关于A图所示实验,下列说法不正确的是.
A.实验时红磷应足量 B.点燃红磷前先用弹簧夹夹紧乳胶管
C.红磷熄灭后立刻打开弹簧夹 D.最终进入瓶中水的体积约为氧气的体积
②B图试管1中的气体为,C图中净化水的方法中活性炭的作用是.
-
(2) 将40g质量分数为35%的浓盐酸,稀释成10%的稀盐酸,需加水的质量为A . 40g B . 50g C . 100g D . 140g
-
(3) 生活中使硬水转化为软水的一种常见方法是,我们应该节约用水,爱护水资源,请你写出一条节约用水的建议..
根据如图AB两种物质的溶解度曲线回答下列问题:

-
(1) t2时,若将120gA 的饱和溶液的质量分数稀释成原溶液质量分数的一半,需加水g
-
(2) t2℃时AB两种物质的饱和溶液降温至t1℃,所得溶液的溶质的质量分数A B(填大于、小于、等于)
要将80g溶质质量分数为10%的食盐溶液变成20%的溶液,可采用的方法为( )
A . 将溶剂蒸发掉原溶剂质量的一半
B . 将溶剂蒸发掉原溶液质量的一半
C . 将溶质质量增加1倍
D . 将溶质质量增加2倍
氧化亚铜与稀硫酸反应的化学方程式为: Cu2O+H2SO4=CuSO4+Cu+H2O。
-
(1) 氧化亚铜中铜、氧元素质量比为
-
(2) 实验室用98%的浓硫酸配制500g、9.8%的稀硫酸,需要水的质量为
-
(3) 取一定量的氧化亚铜,加入9.8%的稀硫酸恰好完全反应,过滤、洗涤、干燥得红色固体6.4g。计算:
①参加反应的稀硫酸的质量
②反应后所得溶液的质量
下列关于溶液的叙述中,错误的是( )
A . 饱和溶液不一定是浓溶液
B . 氢氧化钠固体溶于水时,液体温度升高
C . 20%的氯化钠溶液中溶质与溶剂的质量比为1:5
D . 从100g质量分数 20%的食盐水中倒出10g,剩余溶液的溶质质量分数仍为20%
使100g20%的KNO3溶液变为10%的溶液,可以采用的方法是:( )
A . 加入80g水
B . 加水使溶液质量为200g
C . 倒出50g溶液
D . 加入10KNO3g,完全溶解
回答下列问题:

-
(1) 阅读如图包装说明,碳酸氢铵是由种元素组成的。
-
(2) 欲将50kg10%的碳酸氢铵溶液稀释成1%的溶液,需加kg水。
请阅读下面的短文,回答问题:
过氧乙酸是抗“新冠肺炎”的主要消毒杀菌剂.过氧乙酸的化学式为:C2H4O3 , 是无色透明液体,易溶于水、酒精,易挥发,有很强的刺激性酸臭味,呈弱酸性,有腐蚀性。贮存过程中会逐渐分解,见光、遇热、有机物或金属等杂质分解更快,急剧分解时发生爆炸.过氧乙酸有很强的氧化性,质量分数在0.005%~1%的水溶液,是不同病毒、病菌的广谱、高效、速效的消毒杀菌剂。
综合分析上述材料,回答下列问题:
-
(1) 过氧乙酸由元素组成。(写名称)
-
(2) 关于贮存及配制过氧乙酸消毒液的下列说法正确的是______。A . 贮存过氧乙酸应注意避光、密闭、低温保存 B . 可以在金属容器中配制过氧乙酸溶液 C . 配制过氧乙酸的稀溶液,可以用手搅拌 D . 消毒、杀菌用的过氧乙酸溶液,应根据用量随时配制 E . 消毒、杀菌用的过氧乙酸溶液,浓度越大越好
-
(3) 请设计一个化学实验,证明过氧乙酸溶液呈酸性:
-
(4) 现要配制质量分数为1%的过氧乙酸的稀溶液5000g,需要市售的质量分数为40%的过氧乙酸溶液g。
质量分数为10%的氢氧化钠溶液倒出一半后,再加水至原来的质量,然后再取其中的一半,则最后剩余溶液中溶质的质量分数为( )
A . 10%
B . 5%
C . 2.5%
D . 7.5%
化学实验室现有质量分数为98%的浓硫酸,现要把100g上述浓硫酸稀释为质量分数为20%的硫酸,稀释后溶液的质量为g,需要水的质量g。
下列有关溶液的说法错误的是( )
A . 溶液加水稀释前后溶质的质量不变
B . 氯化钠溶于水就是钠离子和氯离子在水分子的作用下均匀扩散到水中的过程
C . 室温下一定量的饱和氯化钠溶液,不能继续溶解少量的硝酸钾固体
D . 洗涤剂能洗去衣服上的油污,原因是洗涤剂具有乳化作用
最近更新



