用水稀释改变浓度的方法 知识点题库
要将100克溶质的质量分数为10%的食盐水稀释为5%,需加水的质量为( )
A . 10克
B . 50克
C . 100克
D . 95克
下图分别与相应的操作过程相对应,其中正确的是( )
A . 向一接近饱和的硝酸钾溶液中不断加入硝酸钾晶体(不考虑温度变化)
B . 向等质量、等溶质质量分数的稀硫酸中分别加入足量的镁片和锌片
C . 向pH=10的氢氧化钙溶液中不断加水稀释
D . 向含有硫酸的硫酸铜溶液中加入过量的氢氧化钠溶液
工业上常用一定浓度的稀硫酸对表面生锈的铁件进行酸洗.某酸洗池里盛有440kg质量分数为40%的硫酸溶液,放入表面生锈的铁件浸泡,浸泡过程中单质铁也有部分损失,假设溶液中只发生了如下反应:
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Fe+Fe2(SO4)3=3FeSO4
取出铁件用水冲洗,冲洗液倒入酸洗池中合并共得到580kg溶液,其中只有H2SO4和FeSO4两种溶质,经过测定硫酸的质量分数降低到5%.计算:
①消耗H2SO4的质量.
②损失的单质铁的质量.
③要使H2SO4的质量分数恢复到40%,需要加入质量分数为98%的硫酸的质量.
100g50%的硫酸溶液配制成10%的硫酸溶液时,需要加水 g.
下列说法中正确的是( )
A . K2FeO4是一种高效净水剂,其中Fe的化合价为+3价
B . 稀释10g质量分数为98%的浓硫酸,可得到质量分数为10%的稀硫酸98g
C . 在电解水的实验中,产生的H2和O2体积比约为1:2
D . 在化学反应前后分子数目肯定没有变化
水和溶液对人类的生产、生活具有重要意义.
-
(1) 鉴别硬水和软水常用的试剂是.
-
(2) 如图是“水中起火”的实验,实验中白磷能在热水中燃烧,热水的作用是:.写出白磷燃烧的化学方程式.

-
(3) 将100g溶质质量分数为30%的过氧化氢溶液,稀释为适用于消毒杀菌的3%溶液,需要加水g.
-
(4) 下表是碳酸钠在不同温度时的溶解度,根据此表回答:
温度/℃
10
20
30
40
溶解度/g
12.2
21.8
39.7
53.2
①碳酸钠的溶液随温度的变化趋势是.
②10℃时将112.2g碳酸钠饱和溶液升温到40℃,至少需要加入质量为g的碳酸钠,溶液才能达到饱和.
化学活动小组欲用溶质质量分数为98%的浓硫酸配制溶质质量分数为19.6%的稀硫酸,计算50g浓硫酸配制溶质质量分数为19.6%的稀硫酸时需加水g.若浓硫酸敞口放置溶质的质量分数将(填“变小”、“变大”或“不变”).
将150g20%的NaCl溶液稀释成15%的NaCl溶液,需加水mL(水的密度为1g/cm3),在用量筒量取水的体积时,若采用如图所示的方法读数(其他操作都正确),则所配得溶液中溶质的质量分数15%(填“大于”或“小于”或“等于”)

下图是实验室制取气体的有关装置图,据图回答下列间题:

-
(1) 实验室中用A来制取O2的化学反应方程式为;
-
(2) 实验室中常用大理石和稀盐酸来制取CO2 , 所有可选择的装置组合为;若要检验制得的气体是CO2 , 请用化学方程式表示出检验的原理:。
-
(3) 小明同学在装置B中加入15%的过氧化氢溶液和Mn O2制取氧气。
①若用F装置收集O2 , 则O2应从(填“a”或“b”)端通入。
②实验中发现不能得到平稳的氧气流,小红同学提出可以从两个方面改进:
一是将制取装置B换为上图中的装置;。
二是将过氧化氢溶液加水稀释,若把50g溶质质量分数为15%的过氧化氢溶液稀释成溶质质量分数为5%的溶液需加水的质量为g。
在实验室里配制100g溶质的质量分数为10%的NaCl溶液。
-
(1) 用NaCl固体和蒸馏水配制溶液时,用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和;
-
(2) 用浓溶液配制稀溶液时,计算的依据是稀释前后的质量保持不变;
-
(3) 下列配制方法可以达到上述实验目的的是___________。A . 将10gNaCl固体与100g水混合溶解 B . 向50g溶质的质量分数为20%的NaCl溶液中加入50g水
葡萄糖(化学式:C6H12O6)是生命体所需要能量的主要来源.有一瓶葡萄糖(C6H12O6)溶液,部分标签如图所示,请计算:

-
(1) 配制这瓶葡萄糖溶液,需要固体葡萄糖的质量为:g.
-
(2) 要把这瓶葡萄糖溶液加水稀释为2%的葡萄糖溶液,需要水的质量为:g.
10%的CaCl2溶液可用作路面保湿剂。欲配制100kg该路面保湿剂,需要水的质量是kg。
为测定生铁中铁的含量,现将一定量的生铁样品与100g质量分数9.8%的稀硫酸恰好完全反应(杂质不溶于水,也不与酸反应),过滤,将所得固体洗涤、干燥后称重为1.4g.请回答下列问题:
-
(1) 若用98%的浓硫酸配制100g质量分数9.8%的稀硫酸,需要加水的质量为
-
(2) 写出上述反应的化学方程式
-
(3) 求解生铁样品中铁的质量(x)的比例式
-
(4) 该生铁中铁的含量为
-
(5) 将反应后得到的滤液小火蒸发掉5.4g水(蒸发水的过程中没有晶体析出),则最终所得溶液中溶质的质量分数为
-
(6) 若工业上用10t含氧化铁80%的赤铁矿炼铁,能炼出上述生铁的质量为t(假设炼制过程中铁矿石的利用率为90%).
为了测定氯化钠和碳酸钠混合物的组成情况,童童同学进行了如下实验。

-
(1) 实验中发生反应的化学方程式为;
-
(2) 求混合物中发生反应物质的质量(X)的比例式为;
-
(3) 混合物中氯化钠和碳酸钠质量的最简整数比为;
-
(4) 用36.5%的浓盐酸配制实验中所用的稀盐酸需加水的质量为;
-
(5) 求蒸发掉100g水后,所得溶液中溶质的质量分数为。
过氧乙酸是一种高效消毒剂,市售过氧乙酸 AB 液二元制剂混合后生成的过氧乙酸质量分数为 18%。现欲配制 90g 质量分数为 2%的过氧乙酸溶液用于喷雾消毒,需要 18%过氧乙酸溶液的质量为( )
A . 1.8 克
B . 10 克
C . 80 克
D . 88.2 克
用溶质质量分数为36%的浓盐酸配制5%的稀盐酸时,不会用到的仪器是( )
A . 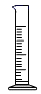 B .
B . 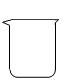 C .
C .  D .
D . 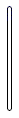
 C .
C .  D .
D .
过氧乙酸是一种常用的消毒剂,其说明书的一部分如图所示,回答下列问题:

-
(1) 保存和配制过氧乙酸不宜使用(填“铁”“玻璃”或“陶瓷”)材料制成的容器。
-
(2) 双氧水和乙酸反应可得到过氧乙酸,该反应的化学方程式为CH3COOH+H2O2=CH3COOOH+X,则X的化学式为。
-
(3) 用质量分数为40%的过氧乙酸溶液配制8000g质量分数为0.5%的过氧乙酸溶液来浸泡消毒,需要取水mL(水的密度为1g/mL)。
科学与人体健康。
-
(1) 人体能够把摄取的含大量淀粉的米饭和馒头等非甜味食品经过消化吸收产生大量葡萄糖。因此,为防止血糖升高,糖尿病人在饮食上要对米饭和馒头等非甜味食品摄入量进行。
-
(2) 生水中大肠杆菌往往含量超标,喝生水容易出现腹泻。生活中人们常用方式,消除去大肠杆菌。
-
(3) 正常胃液的pH为0.9-1.8.若pH<0.9为酸度过高,pH3.5-7.0为低酸,pH>7.0为无酸。某同学胃酸(主要成分为盐酸)pH=0.07,中医可用一种墨鱼骨粉【主要成分为CaCO3】治疗无溃疡型的过多胃酸,其原理是(用化学方程式表示)。
-
(4) 如图是医用生理盐水的部分标签。配制一瓶0.9%500ml生理盐水(生理盐水的密度近似按1g/ml),需要20%的氯化钠溶液的质量是 。

甲、乙两种物质的溶解度曲线如图所示。下列说法正确的是( )

A . 甲的溶解度大于乙的溶解度
B . a1℃时,甲、乙饱和溶液中所含溶质质量相等
C . 乙溶液从a2℃降温至a1℃,一定会有晶体析出
D . 30g甲的溶液稀释到质量分数为原来的一半需加水的质量为30g
氢氧化钠溶液是实验室常用的一种碱液。现要将质量分数为30%的500 g 氢氧化钠溶液稀释为10%,需加多少质量的水?
最近更新



