碱的化学性质 知识点题库
-
(1) 工业制烧碱:
-
(2) 农业.
(1)熟石灰可由生石灰溶于水制得,反应的化学方程式是: .测量其溶液的pH时,应该用 ,再用标准比色卡比较试纸显示的颜色,读取该溶液的pH.
(2)用石灰浆粉刷墙壁,干燥后墙面变硬,反应的化学方程式是: .
(3)用熟石灰粉与草木灰(主要成分:K2CO3)按一定比例混合可制得高效环保农药“黑白粉”.在有露水的早晨,把“黑白粉”撒在植物茎叶上,可杀灭某些害虫.
①“黑白粉”比熟石灰更高效,是由于生成了碱性更强的KOH,反应的化学方程式是 .
②“黑白粉”还可提供植物必需的营养素是 (填元素符号).
A物质构成 | B化学之最 |
①分子、原子、离子都是构成物质的微粒 ②空气、液氧、过氧化氢中都含有氧分子 ③原子都由质子、中子、电子构成 | ①空气中含量最多的物质是氧气 ②地壳中含量最多的金属元素是铝 ③相对分子质量最小的氧化物是水 |
C实验记录 | D实验方法 |
①用10mL量筒量取8mL水 ②酚酞溶液中滴入浓氨水,溶液会变红 ③用托盘天平称取5.68g食盐 | ①鉴别O2、CO2﹣﹣用澄清石灰水 ②熄灭酒精灯﹣﹣用灯帽盖灭 ③鉴别硬水和软水﹣﹣用肥皂水 |
①取适量样品放入试管中,滴加酚酞溶液,溶液变成红色,再向试管中逐滴加入过量的氢氧化钡溶液,观察到有白色沉淀A产生,过滤,所得滤液B为红色.
②取白色沉淀A加入过量的稀盐酸,观察到有气泡产生,并且有不溶物.
③取滤液B加入过量的稀硝酸和过量的硝酸银溶液,得到溶液C和白色沉淀
-
(1) 由实验可知:该样品中一定含有的物质(写化学式,下同),一定不含有的物质是.
-
(2) 在实验③中加入过量的稀硝酸的目的是;
-
(3) 溶液C中,除了酚酞以外,一定含有的溶质有;
-
(4) 为了进一步探究样品中可能含有的物质确实存在,可以补充实验操作和现象(选其中一种可能含有的物质)。
-
(1) 甲和硫酸铜溶液的化学方程式为.
-
(2) 若在甲、乙两种混合溶液中加入几滴酚酞溶液,然后逐滴加入足量稀盐酸.其中可观察到的实验现象有哪些?
-
(1)
气体制取。
按如图1所示的制取装置进行实验。

①写出有标号仪器的名称:a ,b 。
②实验室制取CO2的反应化学方程式是。
③实验室收集CO2的方法是,
原因是。
-
(2)
实验探究。
[提出问题] 实验室制取CO2时能否采用排水法收集?
[设计实验]
实验一:向一个充满CO2气体的质地较软的塑料瓶中加入约1/3体积的水,立即旋紧瓶盖,用力摇晃塑料瓶。可观察到塑料瓶 ,说明CO2能溶于水。
实验二:先用集气瓶装满一瓶蒸馏水(pH=7.0),然后按如图2所示组装装置并进行实验,再用pH计测定从装置C排到烧杯中的液体的pH。

测得烧杯中液体的pH<7.0,说明溶液呈酸性,原因是。
[实验结论] 实验室制取CO2不宜采用排水法收集。
[拓展延伸] 某同学先对图2装置做了以下改进:将装置C中的部分蒸馏水换成植物油,将烧杯换成量筒(如图3所示)。然后利用改进后的装置测定收集到CO2的体积,测得气体的实际体积小于理论值,原因可能是:①,②。

(一) 微观粒子模型化是研究化学变化的重要方法。

-
(1) 图甲是钠与氯气反应生成氯化钠示意图。该图说明在化学反应过程中一定发生变化的是(填序号)。
a.原子核
b.原子的最外层电子数
c.原子的电子层数
-
(2) 图乙是硫酸铜溶液与氯化钡溶液反应的示意图。该反应的实质是A+B→C,请用微粒符号表示该反应的实质。
-
(3) (二) 控制变量、设计对比实验是实验探究的重要方法。

实验1振荡3个塑料瓶,观察到塑料瓶变瘪的程度由大到小为(用A、B、C填写),其中变浑浊的瓶内发生反应的化学方程式为 ;对比A瓶与(填“B”或”C”)瓶的实验现象,可证明CO2能与NaOH发生反应。
-
(4) 实验2探究物质燃烧的条件。将大小相同的红磷和白磷放在薄铜片的两侧,加热铜片的中部,观察现象。通过此实验,可说明燃烧的条件之一的是_____________(填序号)。A . 可燃物 B . 空气 C . 温度达到着火点
-
(5) 实验3是探究铁钉条件的实验,会出现明显现象的是试管(填“I”“II”或“III”),说明铁生锈实际上是铁与发生反应。
选项 | A | B | C | D |
实验目的 | 鉴别硬水 | 鉴别硫酸铵和氯化钠 | 除去二氧化碳中少量的水蒸气 | 除去氯化铜溶液中的少量盐酸 |
方案 | 加肥皂水 | 加熟石灰粉末研磨 | 通过固体氢氧化钠 | 加过量的氧化铜粉末,过滤 |

-
(1) 白色粉末一定不含,可能含有。
-
(2) 为了确定白色粉末的组成,还需要对无色滤液中呈碱性的物质进行探究。
(提出问题)无色滤液中呈碱性的物质是什么?
(猜想假设)猜想一:NaOH
猜想二:
猜想三:Na2CO3和NaOH
-
(3) (进行实验)
实验步骤
实验现象
结论
①取少量该溶液于试管中 滴入溶液。
猜想三正确
②静置上述溶液,取少量上层清液于另一试管中,滴入几滴溶液。
步骤1中发生反应的化学方程式为。
-
(4) (得出结论)白色粉末的成分是。

-
(1) 能产生气泡的是(填序号)。
-
(2) 能证明C中发生反应的现象是。
-
(3) 有一只烧杯中的物质不与稀盐酸反应,原因是。
 向等质量的氧化钙、氢氧化钙中分别加入等质量分数的稀盐酸至过量
B .
向等质量的氧化钙、氢氧化钙中分别加入等质量分数的稀盐酸至过量
B .  向一定质量氯化亚铁和氯化铝的混合溶液中加入镁粉至过量
C .
向一定质量氯化亚铁和氯化铝的混合溶液中加入镁粉至过量
C .  向盐酸和氯化钙的混合溶液中逐滴加入纯碱溶液至过量
D .
向盐酸和氯化钙的混合溶液中逐滴加入纯碱溶液至过量
D .  向等质量的镁、铝中分别加入等质量分数的稀硫酸至过童
向等质量的镁、铝中分别加入等质量分数的稀硫酸至过童


据图回答问题:
-
(1) 反渗透膜法与滤纸过滤法在原理上都是利用混合体系中各物质的不同进行分离的方法。
-
(2) 过程④采用蒸发结晶的方法,而不采用冷却热饱和溶液方法,原因是。
-
(3) 如果要充分利用海边贝壳资源,过程⑤生成氢氧化镁的化学方程式是。
-
(4) 离子交换膜是对特定离子的选择性透过膜,可以使带特定电量的离子透过。过程②中“某种离子交换膜”选择透过的离子特点是。
-
(5) 浓海水中Mg2+、SO42-、Ca2+可用离子交换膜直接除去,若用化学沉淀法依次除去Mg2+、SO42-、Ca2+ , 需要的三种离子依次是(写离子符号)。

资料1:垃圾焚烧产生的烟气中含有SO2 等有害气体;
资料2: FeSO4 容易被空气中的O2氧化。
回答下列问题。
-
(1) 吸收步骤中,石灰浆的作用是。
-
(2) 溶解步骤中同时发生的三个反应的化学方程式分别为
 、
、  、。
、。
-
(3) 将所得FeSO4溶液在氮气环境中蒸发浓缩、降温结晶、过滤,得到FeSO4晶体,其中氮气的作用是。
-
(4) 政府倡导垃圾分类,其好处之一是。
|
用品 |
脱氧剂 |
洁厕灵 |
炉灶清洁剂 |
|
有效成分 |
还原铁粉 |
盐酸 |
氢氧化钠 |
-
(1) 他清理垃圾时发现一袋脱氧剂, 拆开后看到还原铁粉已生锈,铁生锈的原因是。
-
(2) 他选用洁厕灵清除铁锈( 铁锈主要成分是氧化铁), 用化学方程式表示其原理。
-
(3) 他清洗炉灶时戴上橡胶手套, 以防清洁剂与皮肤直接接触, 其原因是。
-
(4) 做完家务,他用 Vc 泡腾片冲了一杯饮料。下列 Vc泡腾片的主要成分中,属于有机物的是(填字母序号)。
A 维生素 C( C6 H8 O6 )
B 柠檬酸( C6 H8 O7 )
C 碳酸氢钠( NaHCO3 )
 )。请回答下列问题:
)。请回答下列问题: 
-
(1) 不同的碱具有相似的化学性质,原因是。
-
(2) 已知熟石灰能与二氧化碳起反应,根据三氧化硫与二氧化碳的类别相同,推断三氧化硫也能与氢氧化钙溶液反应,反应的方程式为。
-
(3) 依据如图性质可知NaOH必须密封保存,否则在空气中容易变质,如果要除去在空气中已变质氢氧化钠溶液中的杂质,应选择适量的下列物质。
A.稀HCl B.稀硫酸 C.CaCl2溶液 D.Ca(OH)2溶液
以上混合物静置后再通过(操作名称),即可达到实验目的,写出除杂的化学方程式。
-
(4) 若碱为氢氧化钠,请写出一个符合性质②的化学反应方程式是,基本反应类型为。

-
(1) A环:NaOH溶液中加入溶液。
-
(2) B环:
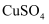 溶液中加入Na2S溶液,生成难溶于水的黑色物质CuS,写出该复分解反应的化学方程式:。
溶液中加入Na2S溶液,生成难溶于水的黑色物质CuS,写出该复分解反应的化学方程式:。
-
(3) 依据下图,向D环中加入(选一种即可)后滴加甲基橙溶液,呈现黄色。




