探究金属锈蚀的条件 知识点题库
-
(1)
铝制品具有很好的抗腐蚀性能,现在世界上铝的年产量已超过了铜。请将方框内横线上的正确答案。

① ;② ;③。
-
(2) 防止金属腐蚀已成为科学研究和技术领域中的重大问题。光亮的铁钉在下列几种情况下,最不容易生锈的是 ( )
A . B .
B .  C .
C .  D .
D . 
-
(3)
某校化学实验室废液桶中收集了溶解大量FeSO4和CuSO4(是重金属污染物之一)的废水,若直接排放到下水道既造成污染又造成浪费。某化学课外小组同学运用所学化学知识对废水进行处理,并回收硫酸亚铁晶体和铜,实验方案如下:

请回答:
①X是(写名称),将其加入废水后发生反应的化学方程式为 ;
②Y是 (写名称),利用其除去固体中的杂质,有关反应的化学方程式为。


-
(1) 实验Ⅰ:通过试管(填序号)对比,可以探究铁钉的锈蚀与氧气有关;通过试管③④对比,可以得出的结论是:。
-
(2) 实验Ⅱ:请你写出装置A中反应的化学方程式并对装置中的不足提出改进意见:
下列对实验Ⅱ的分析正确的是 (填写序号)①因为二氧化碳是炼铁过程中的还原剂,所以应先通一会儿一氧化碳,再加热
②实验结束后,玻璃管中的固体物质的质量比反应前减少了
③反应结束后应立即停止通入一氧化碳
④实验结束后,玻璃管中固体粉末变为黑色
-
(3) 实验Ⅲ:兴趣小组为探究酸的化学性质,他们将一定量稀硫酸加入到盛有少量氧化铜的烧杯中,观察到黑色粉末全部溶解,溶液显色
-
(4) 【拓展研究】兴趣小组同学又进行了如下实验:取124.5g该反应后溶液于烧杯中,然后将120g氢氧化钠溶液分6次加去其中,每次充分反应后称量所得溶液的质量,测量数据如下表所示:
第一次
第二次
第三次
第四次
第五次
第六次
加入氢氧化钠溶液的质量/g
20
20
20
20
20
20
反应后溶液的质量/g
144.5
164.5
179.6
189.8
200
220
产生沉淀的质量/g
0
0
m
9.8
9.8
9.8
请回答:
①第一次,第二次不产生沉淀的原因是:
②上述表格中产生沉淀的质量:m=
③请计算所加氢氧化钠溶液的溶质质量分数(要求写出具体的计算过程)
-
(1) 实验:
步骤
操作
现象
结论
①
取适量固体于试管中加热,用一干冷的玻片置于试管口上方
固体中含有水
②
取适量固体于试管中,加入足量的稀盐酸,观察溶液颜色
溶液呈黄色
固体中含有Fe2O3
③
收集步骤②试管中产生的气体,
有爆鸣声
固体中含有
④
将上面反应后的混合液过滤
有黑色固体
黑色固体的主要成
分是
-
(2) 表达:写出步骤②反应的一个化学方程式:。
-
(3) 拓展:取2枚未生锈的铁钉,一枚部分浸入蒸馏水,另一枚部分浸入盐水,生锈较快的是,铁生锈是铁和氧气和反应的结果。

-
(1) 用图A 所示装置蒸发食盐水时,玻璃棒的作用是。
-
(2) 用图B 所示装置在空气中点燃氢气,该反应的化学方程式为。在点燃氢气等可燃性气体前,一定要先。
-
(3) 图 C 所示装置是探究铜生锈的部分实验,铜锈的主要成分是碱式碳酸铜[Cu2(OH)2CO3] 。实验所用铜片形状、大小相同。一段时间后,试管①中铜片保持光亮,试管②中铜片出现绿色锈渍。对比试管①②的实验现象,得出的结论是。
-
(4) 甲同学用图D 所示装置探究二氧化碳能否与氢氧化钠发生反应。他向盛满二氧化碳的软塑料瓶中倒入 10%的氢氧化钠溶液 50mL,迅速拧紧瓶盖,振荡,观察到软塑料瓶变瘪。由此得出结论:二氧化碳能与氢氧化钠发生反应。乙同学认为甲同学的实验方案不严谨,理由是。乙同学利用图D 所示装置,补做一个对比实验:将甲同学实验中的换成,实验步骤与甲同学完全相同,对比两个实验的现象得出结论: 二氧化碳能与氢氧化钠发生反应。
 探究水对铁生锈有无影响
B .
探究水对铁生锈有无影响
B . 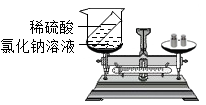 探究质量守恒定律
C .
探究质量守恒定律
C .  探究铝、铜、银的金属活动性顺序
D .
探究铝、铜、银的金属活动性顺序
D . 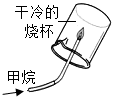 探究甲烷的组成
探究甲烷的组成
-
(1) 该小组设计如图1研究铁的冶炼.

①实验时,应先注水片刻后再加热的目的是.
②硬质玻璃管中发生反应的化学方程式是.
-
(2) 该小组又设计如图2装置,将反应所得铁粉置于锥形瓶底部,塞紧瓶塞,滴加适量食盐水,开始测量容器内压强的变化.压强与时间变化关系如图3所示:锥形瓶内压强下降的原因是。

-
(1) 要达到实验目的还需补充什么实验?
-
(2) 写出用盐酸除铁锈(Fe2O3)的化学方程式。

-
(1) 一周后,该同学观察到试管(填序号)中的铁钉锈蚀最严重.
-
(2) 对照实验A、B,可知铁锈蚀的条件之一为.
-
(3) 铁锈覆盖在铁制品表面不能阻止铁制品继续被锈蚀的原因是(填序号)
①铁锈能与内部的铁继续发生反应 ②铁的金属活动性非常强 ③铁锈很疏松.
-
(1) 在建造过程中用到了水泥、砂浆、钢圆筒等物质,其中属于金属材料的是。
-
(2) 自行车的车架表面刷油漆可防锈,其原理是隔绝了。
(一)工业上炼铁炼钢和轧制钢材的主要流程如下图:

已知:生铁的含碳量为2%~4.3%,钢的含碳量为0.03%~2%。
-
(1) 炼铁的固体原料中加入焦炭的作用是,(用方程式表示);
-
(2) 炼铁的固体原料需经过粉碎,其目的是;
-
(3) 热空气和高炉气体的主要成分有一种相同,这种气体是(填化学式);
-
(4) 炼钢炉中,通入纯氧而不用空气的目的是。将钢锭轧成钢板,体现了金属的性。
-
(5) (二)该兴趣小组发现未经处理的钢铁容易生锈。同学们接着探究了铁生锈的相关问题。
(知识回顾)铁生锈的条件为铁与、同时接触,为了防止铁制品生锈,应采取的措施是(写出一种)。
-
(6) (查阅资料)铁锈成分复杂,化学式可简单表示为Fe2O3•nH2O,在加热时会分步反应,首先失去结晶水,其反应可表示为Fe2O3•nH2O
 Fe2O3+nH2O。浓硫酸可以吸水,碱石灰可以吸收水和二氧化碳。
Fe2O3+nH2O。浓硫酸可以吸水,碱石灰可以吸收水和二氧化碳。 (提出问题)铁锈(Fe2O3•nH2O)中n的值等于多少呢?
(问题探究)小明发现实验室中有一保管不善的铁粉,大部分已经结块成红褐色,为了探究铁锈(Fe2O3•nH2O)的组成,称取27.0g这种铁粉样品,按如图2所示装置进行实验。

实验前应先;
-
(7) 为了保证实验安全,实验开始时应先,目的是;
-
(8) D的作用是;
-
(9) 请指出该装置中有一处明显不足;
-
(10) (数据处理)图3是加热时间和A中固体质量关系图象,下表是B、C中质量不再变化时B中浓硫酸、C中碱石灰装置质量变化情况。

反应前(g)
反应后(g)
B
100
105.4
C
150
163.2
铁锈(Fe2O3•nH2O)中n的值是;
-
(11) 写出T3﹣T4时间段发生反应的化学方程式;
-
(12) 计算原样品中单质铁的质量分数是。(计算结果保留到0.1%)
| 选项 | 实验目的 | 实验设计 | 选项 | 实验目的 | 实验设计 |
| A | 探究温度对分子运动快慢的影响 | | B | 探究水对铁钉锈蚀的影响 | |
| C | 探究空气是燃烧的必要条件 | | D | 探究CO2与 水发生反应 | |

查阅资料:CuSO4+5H2O=CuSO4·5H2O,CuSO4为白色固体,CuSO4·5H2O为蓝色固体
探究I:探究铜锈的组成
用图2所示装置进行实验。观察到澄清石灰水变浑浊,干燥管内白色粉末变为蓝色,试管中固体由绿色变为黑色。
探究Ⅱ:探究铜生锈的条件
在探究Ⅰ的基础上,同学们设计了如图3所示的装置。在同一实验室的自然环境中,进行了如下两个实验,回答下列问题:
| 实验序号 | 甲 | 乙 |
| 实验操作 | 在250mL的集气瓶中装有100mL氧气、100mLCO2 和50毫升水 | 在250mL的集气瓶中装有200mLCO2和50毫升水 |
| 实验现象 | 第3天,出现黑色斑点,之后面积逐渐扩大并增厚,第9天略显绿色 | 无明显现象 |
-
(1) 由探究I推测,铜锈中含有的元素有。
-
(2) 探究II的基本猜想是。
-
(3) 由探究II推断,防止铜生锈的思路是。
-
(4) 在上述探究的基础上,关于铜生锈,你还想继续探究的问题是。
-
(5) 针对你提出的问题,验证实验的设计是

-
(1) 写出标号仪器的名称:①;②。
-
(2) 实验室用装置B制取氧气的化学方程式为。
-
(3) 下列混合气体(括号内气体为杂质)能用装置C进行除杂、干燥、收集的是(填序号)。
①O2(CO2)
②CO2(HCl)
③NH3(O2)
④H2(H Cl)
-
(4) 利用装置D进行实验探究得出铁生锈的条件是;若U形管水中的丝棉也产生少量锈迹,说明该实验还需改进,你的改进方法是。
|
实验一 |
实验二 |
|
| |
-
(1) 实验一:
①实验室用高锰酸钾制取氧气应选用的装置是,(填字母),发生反应的化学方程式为。
②装置C、D是收集到的两瓶氧气,若进行铁丝在氧气中燃烧的实验,应选用的一瓶是(填字母);实验中可观察到铁丝剧烈燃烧,。
-
(2) 实验二:三天后,观察到序号为的试管中铁钉明显生锈。对照实验①和③,可知铁锈蚀与有关。

| 序号 | 样品 | 量筒起始读数/mL | 量筒最终读数/mL | 所需时间/min |
| ① | 1g铁粉0.2g碳和10滴水 | 100 | 72 | 约120 |
| ② | 1g铁粉、0.2g碳、10滴水和少量NaCl | 100 | 72 | 约70 |
| ③ | ______ | / | / | / |
-
(1) 金属腐蚀过程实际上就是金属元素化合价(填“升高”或“降低”)的过程。
-
(2) 实验①和②说明NaCl可以(填“加快”或“减慢”)铁锈蚀的速率。
-
(3) 实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是(填“放热”或“吸热”)过程。
-
(4) 实验①和③是探究碳对铁锈蚀速率的影响,则表格空白处填写实验③的样品组成是。
-
(5) 该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是%(精确到小数点后1位),试分析该实验结果出现误差的原因(写任意一条即可)。
-
(1) (查阅资料)了解到这层锈渍的化学成分是碱式碳酸铜(Cu2(OH)2CO3),俗称“铜绿”。“铜绿”在干燥的空气中加强热,生成三种氧化物。试写出该反应的化学方程式,该反应属于(填写反应类型)反应。
-
(2) (猜想与假设)经仔细观察水龙头的使用环境后,据“铜绿”的组成和查阅的资料判断,“铜绿”可能是金属铜与(填写物质名称)共同作用而形成的。
-
(3) (设计实验一)借鉴教材“铁钉锈蚀条件的探究”实验,他们设计了“铜片锈蚀条件的探究”实验。实验如图所示(所用铜片洁净、光亮)。实验较长时间后,发现试管
-
(4) (填写试管编号)中铜片最先生锈。

(设计实验二)称取一定质量的碱式碳酸铜(Cu2(OH)2CO3)粉末放入烧杯中,加入100g一定质量分数的稀硫酸,反应开始至恰好完全反应(假设气体全部扩散),得到不饱和溶液。测得实验过程曲线如图所示。(反应原理:
 )
)试回答下列问题:

①实验中生成X的质量是g。
②计算该稀硫酸中溶质的质量分数。(计算结果精确到0.1%)

-
(1) 实验A,观察到的现象是。
-
(2) 实验B,目的是探究铁生锈与有关。
-
(3) 实验C,反应结束后,观察到天平的指针(填“不变”、”偏左”或”偏右”),原因是(用化学方程式表示)。
-
(4) 实验D,用酒精灯在中间位置加热一段时间。
①白磷先燃烧,a处红磷后燃烧,原因是。
②b处红磷拨开细沙后才燃烧,证明了燃烧的一个条件为。
③磷燃烧的化学方程式为。

-
(1) 铁丝在氧气中燃烧时的化学方程式为。
-
(2) 过滤操作中玻璃棒的作用是。
-
(3) 对比一段时间后三枚铁钉生锈程度,可以得出铁生锈的条件是。
-
(4) 烧杯中白磷(着火点40℃)不燃烧的原因是。

【实验步骤】
①按图1所示装配仪器并装好试剂,观察试管①和②中铁钉的生锈情况。
②打开弹簧夹,将气囊中的氧气鼓入,直至试管①中一半的冷却沸水排入试管②时(如图2所示),关闭弹簧夹。观察试管③和④中铁钉的生锈情况。
【实验现象】
试管①和②中的铁钉不生锈,③和④中的铁钉生锈,且③比④中的铁钉生锈严重。
【实验分析】
-
(1) 铁锈的主要成分是 (填名称)。
-
(2) 要实现“试管①中一半的冷却沸水排入试管②”,带a、b导管的橡皮塞可选择下中的 。

-
(3) 试管③中的铁钉比试管④中的铁钉生锈严重的原因是 。
-
(4) 要对比铁生锈需要水,应选择图1、图2实验中的试管编号是 。
-
(5) 该实验中,若用“冷却的食盐水(不含氧气)”代替“冷却的沸水”,则试管③中的铁钉生锈速度 (选填“更慢”、“更快”或“不受影响”)。
-
(6) 该实验中,若“氢气”代替气囊中的“氧气”,则对比各试管中的铁钉生锈情况, (选填“能”或“不能”)得出铁生锈需要的条件。









