催化剂的特点与催化作用 知识点题库
如图所示是实验室常用的气体制取装置.在用双氧水和二氧化锰制取氧气的实脸中,可选用的发生和收集装置是(填装置的编号).在此反应中,二氧化锰的作用是 . 
同学想研究不同的氧化物能否在氯酸钾制取氧气实验中起催化作用,进行了以下实验:
实验编号 | KClO3/g | 氧化物 | 产生气体的体积(mL) | 耗时(s) |
1 | 0.6 | / | 9.8 | 480 |
2 | 0.6 | 0.2g二氧化锰 | 67 | 36.5 |
3 | 0.6 | 0.2g氧化铜 | 67 | 89.5 |

-
(1) 写出实验2反应的化学方程式 ;
-
(2) 为证明氧化铜是该反应的催化剂,同学们又完成了以下的实验:
Ⅰ.在实验3反应后的混合物中加足量的水溶解,过滤,将滤渣洗涤并干燥,用电子天平称量,质量为0.2g.
Ⅱ.将过量的CO通入滤出的固体,
按如图进行实验:仪器a的名称 .
-
(3) 甲同学的实验报告如下:
装置
现象
实验结论
A
黑色固体全部变红
生成了铜,反应方程式
B
石灰水变浑浊
产生了二氧化碳
Ⅲ.该实验装置存在的缺陷是 ;当出现 现象时,证明反应已经开始.
-
(4) 以上实验证明氧化铜在反应前后质量和化学性质都没改变,能作为氯酸钾受热分解的催化剂.两种氧化物相比,的催化效果更好.

-
(1) 请写出臭氧的化学式;臭氧与氧气化学性质不同的原因是;
-
(2) 经过①②③的反应后,氯原子的个数(填“减少”或“增加”或“不变”),反应①中的氯原子与反应③中的氯原子化学性质(填“相同”或“不同”);
-
(3) 有科学家指出:“少量的氟利昂就能臭氧层产生巨大的影响”,请你根据循环示意图说明理由.
 镁在氧气中燃烧
B .
镁在氧气中燃烧
B .  向二氧化锰中加入过氧化氢溶液
C .
向二氧化锰中加入过氧化氢溶液
C .  向一定量铁粉和铜粉的混合物中加入硫酸铜溶液
D .
向一定量铁粉和铜粉的混合物中加入硫酸铜溶液
D .  等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应
等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应

-
(1) 【探究一】过氧化氢溶液与二氧化锰的加入顺序
实验Ⅰ向试管中缓缓加入过氧化氢溶液,反应的化学方程式是.
实验Ⅱ中加入二氧化锰后,试管中快速产生大量气泡.实验Ⅰ、Ⅱ相比,可以得到平稳气流的是(填序号)
-
(2) 【探究二】寻找新的催化剂
实验Ⅲ中加入红砖粉末后试管中产生大量气泡,检验该气体成分的方法是,这是利用了该气体具有的性质.待试管中不再产生气泡时,重新加入过氧化氢溶液,并再次检验气体,如此反复多次,观察现象,该实验目的是.将实验后的剩余物小心过滤,并将滤渣洗净、干燥、称量,所得固体仍为ag.通过上述过程得出的结论是.
实验Ⅱ与实验Ⅲ对比,探究的问题是.
实验拓展:查阅资料得知,CuO、CuSO4溶液、猪肝、马铃薯等都可以作过氧化氢分解的催化剂.下列有关催化剂的说法中正确的是.
A.催化剂只能是固体
B.催化剂就是二氧化锰
C.催化剂也可能减慢化学反应速率
D.同一个化学反应可以有多种催化剂
E.使用催化剂能增加生成物的产量.
| | | |
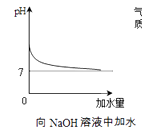
A.向一定质量的AgNO3溶液中滴加NaCl溶液 | B.两份等体积5%的过氧化氢溶液,向其中一份加入少量二氧化锰 | C.在恒温条件下,将饱和的KNO3溶液蒸发适量水 | D.向氢氧化钠溶液中不断加水 |
 B .
B . 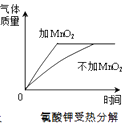 C .
C . 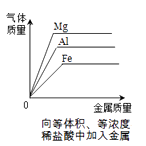 D .
D . 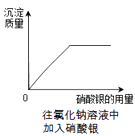

【定性研究】
-
(1) 如图甲,可通过观察来定性比较两者的速率影响效果.
-
(2) 【定量研究】
如图乙,实验前检查该装置气密性的方法是.要定量比较两者的速率影响效果,可测量生成等体积气体所需的.
-
(3) 【深入研究】
在FeCl3溶液中,究竟是哪种粒子影响过氧化氢的分解速率?
猜想1:水分子(H2O)影响过氧化氢的分解速率;
猜想2:影响过氧化氢的分解速率;
猜想3:影响过氧化氢的分解速率;…
请设计实验,验证猜想
实验操作
实验现象
实验结论
分别取同温度同体积同浓度的H2O2溶液于2支试管中,再分别加入等质量的FeCl3和NaCl.观察现象.
加入FeCl3的试管中产生的气体快,加入NaCl的试管中产生的气体慢.
证明是Fe3+影响过氧化氢的分解速率
-
(4) 【反思与讨论】上述实验确实可以证明Fe3+可以改变过氧化氢的分解速率,但不能证明FeCl3是过氧化氢分解的催化剂.若要证明FeCl3是过氧化氢分解的催化剂,还需要通过实验证明FeCl3在反应前后.
请写出FeCl3催化H2O2分解的化学方程式.
物质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量/g | 40 | 3 | 10 | 15 |
反应t时刻的质量/g | 23 | 19 | a | |
反应后的质量/g | x | y | 28 | 31 |
-
(1) (猜想)
Ⅰ.氧化铁不是反应的催化剂、也不参与反应,质量和化学性质反应前后均不变;
Ⅱ.氧化铁参与反应产生氧气,反应前后质量不变,但化学性质发生了改变;
Ⅲ.氧化铁是反应的催化剂,反应前后。
-
(2) (实验)用天平称0.2g氧化铁,用试管取5mL 5%的过氧化氢溶液,进行如图实验:
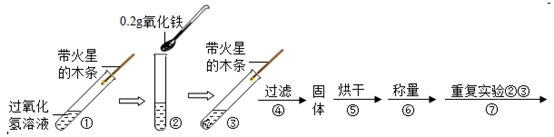
(注:氧化铁不溶于水,过滤可与水分离)
填写如表:
步骤3现象
步骤6结果
步骤7现象
结论
带火星的木条复燃
过氧化氢溶液中,
猜想1、Ⅱ不成立,
猜想Ⅲ成立
-
(3) 步骤①的目的是。
-
(4) 步骤⑦重复实验②、③目的是。
 B .
B .  C .
C .  D .
D . 

已知:B为黑色固体,C、E均为无色气体,其中E是最轻的气体,能将金属氧化物还原为金属单质,F、G均为金属单质,其中F为红色。请回答下列问题:
-
(1) 物质G可能是(填写化学式)
-
(2) 物质B在反应①中的作用是
-
(3) 反应④的化学方程式为
-
(4) 实验室制取较为纯净的气体E时可用法进行收集。
-
(1) 实验一:在探究镁条性质的实验中,甲、乙两位同学的实验记录如下:
甲:镁条灰黑色,不易点燃,放在白醋中反应很慢,较长时间以后才有气泡冒出。
乙:镁条有银白色金属光泽,在空气中可以燃烧。在白醋中很快溶解并产生气泡,产生气泡的速率先是越来越快,后又变慢直至停止,且试管壁发烫。
已知:化学反应的剧烈程度与反应物的性质、反应物的浓度、温度、接触面积等因素有关。

差异分析:你认为甲同学在实验过程中缺少了哪一个步骤:。
-
(2) 镁在空气中燃烧的化学符号表达式为。
-
(3) 研究小组的同学对镁条与白醋的反应进行了探究。将橡胶塞连接气体压力传感器,锥形瓶中放入一定量的镁条,针筒中放入白醋,塞紧瓶塞,将针筒中白醋推入锥形瓶并打开仪器(如图1所示)。一段时间后,得到气体压强与时间的关系曲线图(如图2所示)。
到C点烧瓶内气压达到最大值说明,CD段气压逐渐下降的原因是。
-
(4) 从AB段到BC段来看,反应的速率是先慢后快,导致变快的主要因素是(填字母)。
a 镁条的表面积 b 白醋的浓度 c 温度
-
(5) 实验二:探究制取氧气的适宜催化剂
某研究小组对H2O2分解的各种催化剂的催化效果进行定量对比探究。小组人员选用海藻酸钠(海藻酸钠是一种天然高分子物质,在本实验中性质稳定,不与其他物质发生反应)作为催化剂支架,制备负载等量催化剂的海藻酸钠微球,利用数字化手持技术展开探究。
(实验过程)取负载各种等量催化剂的海藻酸钠微球各30粒分别放入a、b、c、d四个锥形瓶中,每个锥形瓶上连接压力传感器和注射器(如图3所示)。

用注射器分别向每个锥形瓶中注入20 mL浓度为5%的H2O2溶液,溶液全部注入后立即采集200 s内压强数据,最后用软件绘制实验图形如图4所示(猪肝研磨液富含过氧化氢酶,酶的主要成分为蛋白质,温度升高时,其活性会降低)。
(实验分析)
上述四种催化剂中催化效果最差的物质是。
-
(6) a、b瓶在60 s左右时压强突然恢复至常压,最可能的原因是。
-
(7) a、b、c瓶中的海藻酸钠微球都浮起来,主要原因。
-
(8) 前50 s内,b、c、d瓶中反应速率越来越快,可能的原因是。
-
(9) 从实验曲线看,催化效果较好。反应温和的催化剂是。
-
(10) 实验中发现a瓶中催化剂的性能随反应进行越来越弱,可能的原因是。

-
(1) 写出实验室中用过氧化氢溶液制取氧气的化学方程式。
-
(2) 对比分析坐标图中的点,可知化学反应速率与催化剂的种类有关。
-
(3) 请从催化剂的角度解释,在实验过程中,上述两个反应虽化学反应速率不同,但完全反应后两个装置内压强相同的原因是。

回答下列问题:
-
(1) A装置中仪器X的名称是。
-
(2) 实验室常以氯酸钾、二氧化锰为原料,用C装置制取、F装置收集氧气。写出该反应的化学方程式:;检验产生氧气的方法:;实验前需检查装置的气密性:连接装置C、F,微热C中试管,若F中产生气泡、且恢复常温后玻璃管内水面水槽的水面,就证明装置气密性良好。
-
(3) 以高锰酸钾为原料、用C装置制取氧气,需要在试管口塞一团棉花,防止。
-
(4) 某研究小组发现,将适量淀粉放入过氧化氢溶液中,过氧化氢溶液的分解速率加快。对于此现象,该小组同学进行了如下探究:
(提出问题)淀粉能否作过氧化氢分解的催化剂?
(作出猜想)淀粉能作过氧化氢分解的催化剂。
(实验验证)
实验步骤
实验现象
结论及解释
Ⅰ.

A中无明显现象,B中产生大量能使带火星木条复燃的气体
产生的气体是氧气;①淀粉能
Ⅱ.向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣
B中又产生大量使带火星②木条复燃的气体;滤渣质量为ag
②淀粉的在反应前后均没有发生变化,能过氧化氢分解的催化剂
写出淀粉催化过氧化氢分解的化学方程式: 。
-
(5) (实验拓展)
该小组设计了如图1所示装置对比淀粉与二氧化锰的催化效果,实验均以生成25mL气体为准,其他可能的影响因素忽略不计,相关数据见表:

实验编号
3%过氧化氢溶液的体积
其他物质质量
待测数据
Ⅰ
20mL
淀粉0.3g
a
Ⅱ
20mL
二氧化锰0.5g
b
上述实验中“待测数据”是指;若a>b,则可得出的结论是。
-
(6) 温度升高过氧化氢的分解速率会加快,某同学取足量5%的过氧化氢溶液进行加热,如图2所示,可实验中带火星的木条往往难以复燃,请解释原因。
(提出问题)铁锈能不能作为过氧化氢溶液分解的催化剂呢?
(作出猜想)铁锈能作为过氧化氢溶液分解的催化剂。
(实验验证)同学们设计了实验装置并进行了气体的制取和测量实验。实验时均以生成40mL气体为标准,相关实验数据记录如下表:
|
实验序号 |
过氧化氢溶液浓度/% |
过氧化氢溶液体积/mL |
过氧化氢溶液温度/℃ |
铁锈质量/g |
收集40mL氧气所用时间/s |
|
① |
5 |
10 |
20 |
0 |
128 |
|
② |
5 |
10 |
20 |
0.5 |
28 |
|
③ |
15 |
10 |
20 |
0.5 |
10 |
|
④ |
5 |
10 |
50 |
0 |
55 |
-
(1) 通过实验②和③可知,过氧化氢溶液的分解速率与浓度的关系是;定量比较反应快慢,除了比较收集40mL氧气所用时间的方法外,还可以采用的方法是。
-
(2) 通过实验和对比可知,加入铁锈后过氧化氢溶液的分解速率加快;若要证明铁锈是过氧化氢溶液分解的催化剂,还需要证明它在反应前后的和没有发生变化。
-
(3) 实验证明铁锈也可以作为过氧化氢溶液分解的催化剂,请你写出这个反应的化学方程式。
-
(4) 上述实验验证了一些影响过氧化氢溶液的分解速率的因素,那么你认为过氧化氢溶液的分解速率还可能与催化剂种类有关,你的实验验证方案是。

A.脯氨酸是氧化物
B.脯氨酸中氮元素质分数最小
C.脯氨酸相对分子质量为115
D.脯氨酸作为催化剂,其化学性质在反应前后(选填“不变”、“改变”)







