蒸馏与分馏 知识点题库
 B .
B . 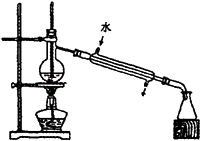 C .
C .  D .
D . 
物质 | 沸点 ℃ | 熔点 ℃ | 溶解性 |
CH3COOH | 117.9 | 16.6 | 能溶于水及酒精等有机溶剂 |
H2O2 | 150.2 | -0.43 | 溶于水及酒精 |
CH3COOOH | 105 | 0.1 | 溶于水及酒精等有机溶剂 |
同时查得过氧乙酸具有:刺激性气味,易燃;加热至100℃即猛烈分解;遇火或受热、受震都可引起爆炸;对金属具有较强的腐蚀性。回答以下问题:
-
(1) 利用如图装置进行制取,实验中水浴温度应控制在100℃(填“>”或“<”或“=”),原因是:

-
(2) 为了使实验顺利进行,B处应接一个(填一种装置),然后缓慢打开图中开关通入空气,从而得到过氧乙酸溶液。
-
(3) 实验结束后得到一定量的过氧乙酸,利用如下反应测定该产物的纯度:
2KMnO4+5H2O2 +3H2SO4=K2SO4+2MnSO4+8H2O+5O2↑
2KI+ CH3COOOH+2 H2SO4=2KHSO4+I2+ CH3COOH+H2O
I2+2Na2S2O3=2NaI+Na2S4O6
①取10.00mL制得的过氧乙酸溶液,加水稀释到1000mL,用移液管取20.00mL至锥形瓶中,加入足量稀硫酸酸化后,再用(填“酸式滴定管”或“碱式滴定管”)装0.100mol/L的KMnO4溶液进行滴定至现象时恰好完全反应,从而将混在过氧乙酸中的H2O2除去。然后再加入过量KI溶液,加入几滴淀粉,再用0.100mol/L的Na2S2O3滴定消耗了12.00mL。一般工业制得的过氧乙酸质量分数为18% ~ 23%。如果测得实验室制得的过氧乙酸溶液密度为1.15g•cm-3。试通过计算判断该溶液是否合格。
②滴定过程中,下列操作会使结果偏大的是。
A.滴加Na2S2O3时开始平视滴定管,结束时俯视滴定管。
B.装标准Na2S2O3溶液的滴定管未用标准Na2S2O3溶液润洗。
C.移液管在使用之前未用烘干,里面附着水珠就用来量取待测液
D. .滴加Na2S2O3时开始仰视滴定管,结束时平视滴定管。
I.现要从工业含碘废液中回收碘单质(废液中含有H2O、油脂、I2、I)。设计如图一所示的实验过程:

-
(1) 为了将含碘废液中的I2完全转化为I—而进入水层,向含碘废液中加入了稍过量的A溶液,则A应该具有性。
-
(2) 下列有关滴定的说法错误的是________(填标号)。A . 标准Na2S2O3溶液应盛装在碱式滴定管中 B . 滴定时眼睛只要注视滴定管中溶液体积的变化 C . 滴定终点时,俯视读数,导致测定结果偏低 D . 滴定到溶液由无色变蓝色时应该立即停止滴定
-
(3) 将在三颈烧瓶中反应完全后的溶液经过操作②获得碘单质,操作②包含多步操作,操作名称分别为萃取、、,在操作②中必须用到下列所示的部分仪器或装置,这些仪器和装置是(填标号)。

-
(4) 用该测定方法测定的碘值需要用相关的实验校正,因为所测得的碘值总比实际碘值低,原因是。
-
(5) 将操作①所得溶液放入图二所示的三颈烧瓶中,并用盐酸调至pH约为2,再缓慢通入适量Cl2 , 使其在30~40℃反应。写出其中发生反应的离子方程式;Cl2不能过量,因为过量的Cl2将I2氧化为IO3- , 写出该反应的离子方程式。
-
(6) 该油脂的碘值为g(列式表示)。
①  ②
② 
③  ④
④ 
-
(1) 用玉米生产燃料乙醇的生产如下图表示:
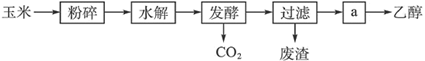
①粉碎玉米的目的是。步骤a的操作是。
②以玉米等淀粉原料生产乙醇的化学反应可用下式表示:
(C6H10O5)n+ nH2O
 nC6H12O6
nC6H12O6C6H12O6
 2C2H5OH + 2CO2↑
2C2H5OH + 2CO2↑100 kg玉米淀粉最多可生产无水乙醇kg。
-
(2) 乙醇汽油在储存和运输过程中应特别注意防水。如果乙醇汽油中混入了水,可能出现现象。
-
(3) 常温下,1g乙醇完全燃烧释放29.71kJ热量,请写出乙醇完全燃烧的热化学方程式。
-
(4) 由玉米等农产品为原料制得的乙醇作燃料,是否是增加大气中CO2的含量,为什么?。
 B .
B . 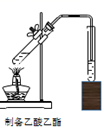 C .
C . 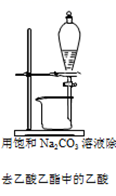 D .
D . 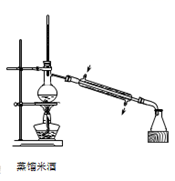
|
乙醇 |
溴乙烷 |
液溴 |
|
|
相对分子质量 |
46 |
109 |
160 |
|
状态 |
无色液体 |
无色液体 |
深红色液体 |
|
密度/(g·cm-3) |
0.79 |
1.44 |
3.1 |
|
沸点/℃ |
78.5 |
38.4 |
59 |
-
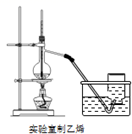
(1) I.溴乙烷的制备:
反应原理如下:
H2SO4+NaBr
 NaHSO4+HBr↑
NaHSO4+HBr↑ CH3CH2OH+HBr
 CH3CH2Br+H2O
CH3CH2Br+H2O实验装置如图(加热装置夹持装置均省略):

图甲中B仪器的名称,作用为。
-
(2) 若图甲中A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应生成了;F连接导管通入稀NaOH溶液中,其目的主要是吸收等尾气防止污染空气。
-
(3) II.溴乙烷性质的探究。用如图实验装置验证溴乙烷的性质:

在乙中试管内加入10 mL 6 mol·L-1 NaOH溶液和2 mL溴乙烷,振荡、静置,液体分层,水浴加热。该过程中的化学方程式为。
-
(4) 若将乙中试管里的NaOH溶液换成NaOH乙醇溶液,为证明产物为乙烯,将生成的气体通入如图丙装置。a试管中的水的作用是;若无a试管,将生成的气体直接通入b试管中,则b中的试剂可以为。

已知:液溴的沸点为58.78℃。质量分数为48.6%的氢溴酸沸点为126℃。回答下列问题:
-
(1) 反应室①使用冰水的目的为。
-
(2) 反应室②中发生反应的离子方程式为。
-
(3) 操作Ⅰ的装置如图所示(部分夹持装置省略),仪器a的名称是,装置中明显的不正确是。

-
(4) 工业生产制得的氢溴酸常常有淡淡的黄色,可能的原因是。
-
(5) 工业上用黄铁矿(主要成分FeS2)在高温下制取SO2 , 其化学方程式为。
-
(6) 若开始加入m1g液溴,得到m2g48.6%的氢溴酸,则其产率为。
 B .
B .  C .
C .  D .
D . 




