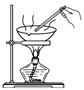
物质的分离与提纯 知识点题库
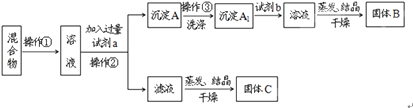
-
(1) 操作①的名称是,操作②的名称是.
-
(2) 试剂a是,试剂b是,固体B是.(填化学式)
-
(3) 加入试剂a所发生的化学反应方程式为:.
加入试剂b所发生的化学反应方程式为:
-
(4) 该方案能否达到实验目的:若不能,应如何改进(若能,此问不用回答).
-
(5) 若要测定原混合物中KCl和BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是(填“A”、“A1”、“B”、“C”)的质量.
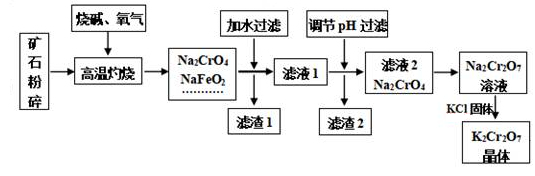
已知:①NaFeO2在水溶液中强烈水解生成对应的氢氧化物.
②2CrO  +2H+⇌Cr2O
+2H+⇌Cr2O  +H2O
+H2O
-
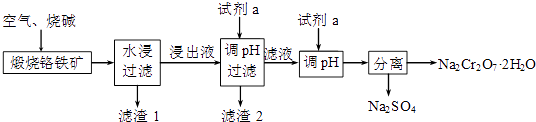
(1) 完成煅烧过程中铬铁矿发生的主要反应的化学方程式:
FeO•Cr2O3+7O2+
 Na2CrO4+NaFeO2+
Na2CrO4+NaFeO2+上述反应中每熔化1mol FeO•Cr2O3 , 转移的电子数为
-
(2) 浸出液的成分除Na2CrO4、NaOH外,还含有(写化学式,下同),滤渣1的成分是.
-
(3) 调节浸出液pH所加的试剂a是(写化学式).
-
(4) 该流程中用了两步调节pH,若合并成一步调pH,酸性过强,产品Na2Cr2O7晶体中可能含有较多杂质,用离子方程式说明引入该杂质的原因.
-
(5) 100kg铬铁矿(含FeO•Cr2O3 89.6%)最多可获得Na2Cr2O7•2H2O的质量为 kg.
物质 | 熔点℃ | 沸点℃ | 密度g•cm﹣3 | 水溶性 |
A | ﹣98 | 57.5 | 0.93 | 可溶 |
B | ﹣84 | 97 | 0.90 | 可溶 |
由此,分离A和B的最佳方法是( )
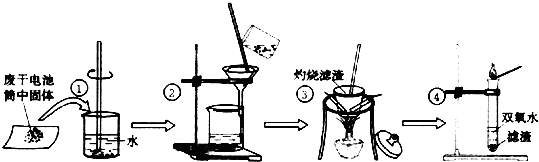
查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质.请回答以下问题:
-
(1) 操作①的名称是;操作②的名称是;
-
(2) 操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、、 和三脚架;操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为.
-
(3) 操作④的试管加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色固体为.
-
(4) 该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2 , 下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
实验目的
操作
实验现象
结论
①.检验Cl﹣
取少许滤液于试管中,加入
产生白色沉淀
含有Cl﹣
②.检验NH4+
取少许滤液于试管中,加入
含有NH4+ k
③.检验Zn2+
取少许滤液于试管中,加入稀氨水
先产生白色沉淀,继续加入氨水,沉淀又溶解
含有Zn2+
-
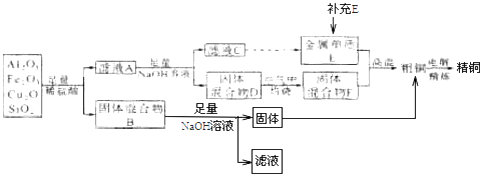
(1) 已知:Cu2O易溶于稀酸溶液,溶液变为蓝色且有紫红色的金属单质生成,写出并配平其反应的离子方程式.
-
(2) 滤液A中铁元素的存在形式为(填离子符号),检验滤液A中存在该离子的试剂为(填试剂名称).
-
(3) 固体混合物B主要含有,其中氧化物的用途为(填写一种用途即可).
-
(4) 金属E与固体混合物F发生反应的化学方程式为.
-
(5) 将Na2CO3溶液滴入到一定量的FeCl3溶液中,有无色无味气体放出,写出相应的离子方程式:.
-
(6) 取10g该铜矿石炼制精铜,可用酸性高锰酸钾溶液滴定法测定粗铜精炼后电解液中铁元素的含量(假设其他物质不与高锰酸钾反应,且流程中不考虑铁元素的损耗).若滴定时用去0.1mol/L的酸性高锰酸钾溶液20.00mL,则该铜矿石中Fe2O3的含量为.

-
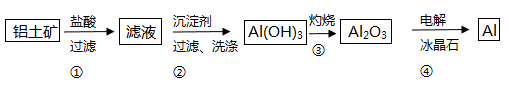
(1) 过程I中采用NaOH溶液溶出废料中的Al,反应的化学反应方程式为.
-
(2) 过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的离子反应方程式为(产物中只有一种酸根).请从反应原理分析不用盐酸酸化的主要原因.
-
(3) 碳酸钠溶液在过程III和IV中所起作用有所不同,请分别用离子方程式表示在过程III、IV中起的作用:.
-
(4) 某天然碱的化学式可表示为2Na2CO3•NaHCO3•2H2O,取少量该物质溶于水得稀溶液P.下列有关溶液P中微粒的物质的量浓度关系正确的是 (填序号).A . c(CO32﹣)>c(HCO3﹣)>c(OH﹣)>c(H+) B . c(OH﹣)=c(H+)+c(HCO3﹣)+2c(H2CO3) C . 3c(Na+)>5c(CO32﹣)+5c(HCO3﹣)+5c(H2CO3) D . 将P溶液与少量NaOH溶液混合:c(Na+)+c(H+)=c(HCO3﹣)+2c(CO32﹣)+c(OH﹣)
-
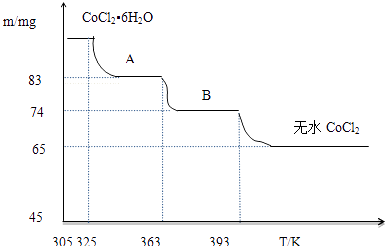
(5) CoO溶于盐酸可得粉红色的CoCl2溶液.CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水.如图是粉红色的CoCl2•6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,B物质的化学式是.
已知:
①NaFeO2常温遇大量水会强烈水解,高温时不与水反应
②2CrO42-(黄色)+2H+ ![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
③+6价的铬元素在强酸性条件下具有强氧化性,还原产物为Cr3+ , 强碱性条件下几乎没有氧化性
请回答下列问题:
-
(1) 将矿石粉碎的目的是。
-
(2) 高温灼烧时生成NaFeO2的化学方程式。
-
(3) ①滤渣1的成分为(写化学式,下同),写出生成该物质反应的离子方程式。
②滤渣2的主要成分是。
-
(4) 若向Na2CrO4溶液中加入浓盐酸进行酸化,出现的现象为
-
(5) 生产后的废水中主要含有一定量的Cr2O72- , 通常加一定量的绿矾进行净化并调节pH约为6,可生成两种难溶于水的沉淀,请写出该反应的离子方程式。
A | B | C | D |
从碘水中分离出碘 |
检验溶液中NH4+的存在 |
干燥SO2气体 |
收集HCl气体 |
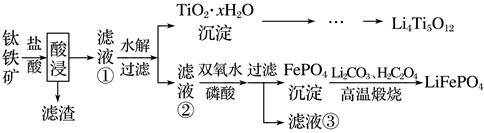
已知:“酸浸”后,钛主要以TiOCl42-形式存在FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
下列说法错误的是( )
-
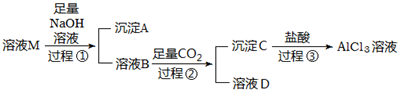
(1) 沉淀A的化学式为,过程①中Al3+发生反应的离子方程式为。
-
(2) 氢氧化钠溶液(填“能”或“不能”)用氨水代替,原因是。
-
(3) 溶液B中大量存在的阳离子是,过程②中生成沉淀C的离子方程式为。
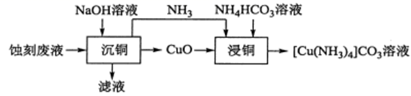
下列有关说法错误的是( )
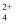 +2OH-
+2OH-  4NH3↑+CuO↓+H2O
C . “滤液”中大量存在的离子有Na+、
4NH3↑+CuO↓+H2O
C . “滤液”中大量存在的离子有Na+、  、Cl-和OH-
D . “浸铜”时温度过高可能导致铜的浸出率下降
、Cl-和OH-
D . “浸铜”时温度过高可能导致铜的浸出率下降
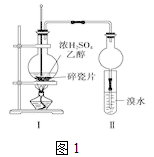

-
(1) 写出该实验中生成乙烯的化学方程式。
-
(2) 甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是。
a.乙烯与溴水易发生取代反应
b.使溴水褪色的反应,未必是加成反应
c.使溴水褪色的物质,未必是乙烯
-
(3) 乙同学经过细致观察后试管中另一实验现象后,证明反应中有乙烯生成,请简述这种这一实验现象。
-
(4) 丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加上图2装置以除去乙醇蒸气和SO2 , 则A中的试剂是,B中的试剂为。
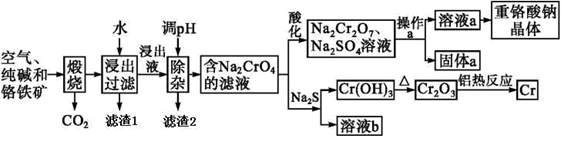

已知部分物质的溶解度曲线如图 1 所示。
请回答下列问题:
-
(1) 若煅烧操作在实验室进行最好选用_____(填序号);A . 石英坩埚 B . 铁坩埚 C . 瓷坩埚
-
(2) 煅烧生成 Na2CrO4 的化学方程式为 。
-
(3) 滤渣 1 的成分为 Fe2O3 , 滤渣 2 的成分除了Al(OH)3之外还有。
-
(4) 操作 a 的实验步骤为,洗涤干燥。
-
(5) 加入
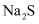 溶液后使硫元素全部以
溶液后使硫元素全部以  的形式存在,写出生成Cr(OH)3的离子方程式。
的形式存在,写出生成Cr(OH)3的离子方程式。
-
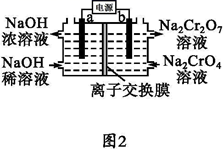
(6) 采用石墨电极电解 Na2CrO4 溶液制备 Na2Cr2O7 , 其原理如图 2 所示。电极 b 为极(填“阳”或“阴”),写出电极 b 的电极反应方程式:。
-
(7) 根据有关国家标准,含
 的废水要经化学处理使其浓度降至5.0×10-7mol·L-1 以下才能排放。可采用加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入硫酸处理多余的Ba2+的方法处理废水。加入可溶性钡盐后,废水中 Ba2+的浓度应不小于mol·L-1 , 废水处理后方能达到国家排放标准。
的废水要经化学处理使其浓度降至5.0×10-7mol·L-1 以下才能排放。可采用加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入硫酸处理多余的Ba2+的方法处理废水。加入可溶性钡盐后,废水中 Ba2+的浓度应不小于mol·L-1 , 废水处理后方能达到国家排放标准。
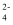 、Cl-、NO
、Cl-、NO  。回答下列问题:
。回答下列问题:
-
(1) 下列离子中,能大量存在于该废水中的是_______(填标号)A . Ag+ B . Mg2+ C . OH- D . HCO

-
(2) 取100mL该废水于烧杯,逐滴加入NaOH溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是Na+、(用离子符号表示)。
-
(3) 某化学社团小组成员欲除去废水样品中的Cu2+和SO
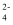 ,最终得到中性溶液,设计的方案流程如图:
,最终得到中性溶液,设计的方案流程如图: 
①试剂c为(写化学式);溶液3所含溶质离子有Cl-、。
②“分离操作”的名称是,需用到的玻璃仪器主要有。
③向“白色沉淀2”中加入足量盐酸,发生反应的离子方程式为。