物质的分离与提纯 知识点题库
现欲分离乙酸乙酯、乙酸、乙醇的混合物,下图是分离操作步骤流程图.字母代表所加物质,数字代表操作方法.下列说法中错误的是( )

混合物 | 试剂 | 分离方法 | |
A | 乙烷(乙烯) | H2、催化剂 | |
B | 甲苯(苯酚) | 溴水 | 过滤 |
C | 溴乙烷(溴) | Na2SO3 | 分液 |
D | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
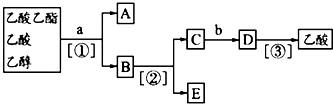
上述实验过程中涉及的三次分离操作分别是( )

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O.
②ClO2的沸点为283K,纯ClO2易分解爆炸,常用稀有气体或空气稀释防止爆炸性分解
③HClO2在25℃时的电离常数与硫酸的第二步电离常数相当,可视为强酸.
-
(1) 160g/L NaOH溶液的物质的量浓度为mol/L.
若要计算该溶液的质量分数,还需要的一个数据是.
-
(2) ClO2发生器中所发生反应的化学方程式为.
-
(3) 吸收塔中为防止产生NaClO2被继续还原成NaCl,所用还原剂的还原性应适中.除H2O2
处,还可以选择的还原剂是 (填序号)
A . Na2O2 B . Na2S C . FeCl2 D . KMnO4 -
(4) 从滤液中得到NaClO2•3H2O晶体还必须进行的操作是 (填操作名称)
Ⅰ.废液组成:
金属元素 | Ni | Mn | Co | Fe | Cu | Zn |
浓度(g•L﹣1) | 45 | 15 | 7.5 | ≤0.1 | ≤0.05 | ≤0.05 |
-
(1) Ⅱ.处理方案:
步骤1:调节pH:向强酸性溶液中加入NaOH溶液调节pH到2.
此步骤中工业上不直接使用饱和Na2CO3溶液来调节溶液的pH的原因可能是.
-
(2) 步骤2:除去Mn2+、Co2+离子:在搅拌下加入适量饱和Na2CO3溶液和NaClO溶液并控制pH≤3.5,过滤.
①Mn2+反应生成MnO2同时放出CO2 , 写出此反应的离子方程式:.
②Co2+反应生成Co(OH)3沉淀同时放出CO2 , 写出此反应的离子方程式:;
Ni2+可反应生成Ni(OH)3沉淀,Co2+可使Ni(OH)3转化为Co(OH)3沉淀,写出Ni(OH)3转化为Co(OH)3的离子方程式:.
③此步骤中必须控制好NaClO溶液的用量,其原因可能是.
-
(3) 步骤3:回收镍
以铅片为阳极,镍铬钛不锈钢片为阴极,电解步骤2中所得滤液,在阴极得到镍
粉.电解过程中电流效率与pH的关系如图所示,分析图表,回答下列问题:
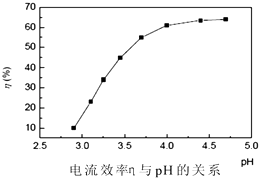
①pH较低时,电流效率低的原因可能是:.
②电解的最佳pH范围是:(填序号).
A.3.0~3.5 B.3.5~4.0
C.4.0~4.5 D.4.5~5.0.
 NH3+H2O+CO2 )
NH3+H2O+CO2 )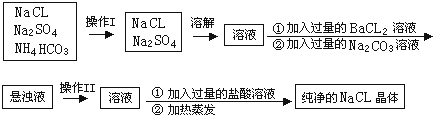
-
(1) 上述操作I、II的名称分别为、.
-
(2) 进行操作“加入过量的BaCl2溶液”时,如何判断BaCL2溶液已过量,其方法是.
-
(3) 操作“加入过量的Na2CO3溶液”的目的是.
-
(4) 操作“加入过量的盐酸溶液”的目的是.
 吸收氨气,并防止倒吸
B .
吸收氨气,并防止倒吸
B .  分离水喝CCl4
C .
分离水喝CCl4
C .  从食盐水中提取NaCl
D .
从食盐水中提取NaCl
D .  石油的分馏
石油的分馏
 B .
B . 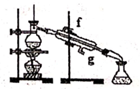 C .
C .  D .
D . 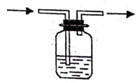
-
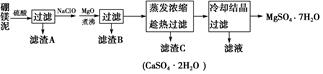
(1) 滤渣A能溶于氢氟酸,写出其反应的化学方程式:。
-
(2) 滤渣B中含有不溶于稀盐酸的黑色固体,则滤渣B含有的成分有,加MgO并煮沸的目的是。
-
(3) 写出加NaClO过程中发生反应的离子方程式:
-
(4) 趁热过滤的目的是。
-
(5) 因B2O3溶于硫酸,所以此法制备的七水硫酸镁含有少量硼酸(H3BO3),硼酸与NaOH溶液反应可制得硼砂,写出该反应的化学方程式:。失去结晶水的硼砂与金属钠、氢气及石英砂一起反应可制备有机化学中的“万能还原剂——NaBH4”和另一种钠盐,写出其反应的化学方程式:。
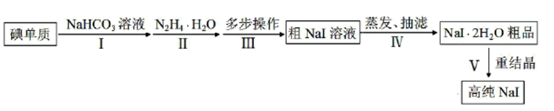
已知:
①I2(s)+I-(aq)  I3-(aq)。
I3-(aq)。
②水合肼(N2H4•H2O)具有强还原性,可分别将碘的各种酸根和I2还原为I- , 本身被氧化为无毒物质。
③NaI易溶于水,也易溶于酒精,在酒精中的溶解度随温度的升高增加不大。
请回答:
-
(1) 步骤Ⅰ,I2与NaHCO3溶液发生歧化反应,生成物中含IO-和IO3-离子。
①I2与NaHCO3溶液反应适宜温度为40~70℃,则采用的加热方式为。
②实验过程中,加少量NaI固体能使反应速率加快,其原因是。
-
(2) 步骤Ⅱ,水合肼与IO‾反应的离子方程式为。
-
(3) 步骤Ⅲ,多步操作为:
①将步骤Ⅱ得到的pH为6.5~7的溶液调整pH值至9~10,在100℃下保温8h,得到溶液A;
②将溶液A的pH值调整至3~4,在70~80℃下保温4h,得溶液B;
③将溶液B的pH调整至6.5~7,得溶液C;
④在溶液C中加入活性炭,混合均匀后煮沸,静置10~24h后,过滤除杂得粗NaI溶液。上述①②③操作中,调整pH值时依次加入的试剂为___。
A . NaOH B . HI C . NH3•H2O D . 高纯水 -
(4) 步骤Ⅳ,采用改进的方案为用“减压蒸发”代替“常压蒸发”。
①“减压蒸发”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管、接收瓶之外,还有。
A.直形冷凝管 B.球形冷凝管 C.烧杯 D.抽气泵
②采用“减压蒸发”的优点为。
-
(5) 将制备的NaI•2H2O粗品以无水乙醇为溶剂进行重结晶。请给出合理的操作排序。
加热乙醇→→→→→纯品(选填序号)。
①高纯水洗涤 ②减压蒸发结晶 ③NaI•2H2O粗品溶解 ④趁热过滤 ⑤真空干燥 ⑥抽滤

已知: TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。回答下列问题:
-
(1) 写出“加压酸浸 1”过程中 Cu2Te 发生反应的化学方程式。
-
(2) “酸浸 2”时温度过高会使碲的浸出率降低,原因为 。要从 Ag 和 Au 中分离出 Au ,可以向回收的 Ag 和 Au 中加入的试剂是 。
-
(3) 写出“还原”反应中发生的离子方程式 。
-
(4) 工业上另一种提取碲的方法是将铜阳极泥在空气中焙烧 , 使碲转化成 TeO2 , 再加NaOH 碱浸,以石墨为电极电解溶液获得 Te。 电解过程中阴极的电极反应式为 。
-
(5) 25 ℃时 , 向 1mol/L 的 Na2TeO3溶液中滴加盐酸 ,当溶液 pH 值约为 6 时 ,此时溶液中 c(
 ):c(
):c(  ) = ( 已知: H2TeO3:Ka1=1.0×10−3 , Ka2=2.0×10−8)
) = ( 已知: H2TeO3:Ka1=1.0×10−3 , Ka2=2.0×10−8)
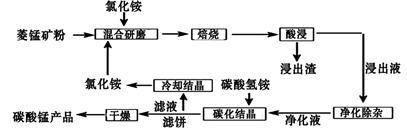
已知①菱锰矿粉的主要成分是MnCO3 , 还有少量的Fe、Al、Ca、Mg等元素②常温下,相关金属离子在浓度为0.1mol/L时形成M(OH)n沉淀的pH范围如表
| 金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
| 沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
回答下列问题:
-
(1) “混合研磨”的作用为
-
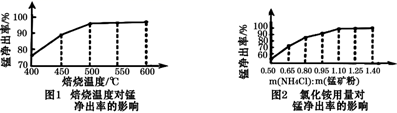
(2) 分析图1、图2,焙烧氯化铵、菱锰矿粉的最佳条件是:温度,m(NH4Cl):(锰矿粉)=。
-
(3) “焙烧”时发生的主要反应的化学方程式为
-
(4) 净化除杂流程如下
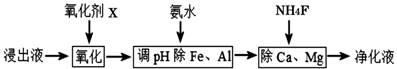
①已知几种物质氧化能力的强弱顺序为(NH4)2S2O8>KMnO4>MnO2>Fe3+ , 常温下KMnO4能氧化盐酸产生氯气,则氧化剂X宜选择
A.(NH4)2S2O8 B.MnO2 C.KMnO4
②调节pH时,pH可取的范围为
③常温下Ksp(CaF2)=3.20×10-12;Ksp(MgF2)=7.29×10-11.当溶液中离子浓度小于或等于1×10-5mol/L时可认为离子沉淀完全。要使Ca2+和Mg2+都沉淀完全,沉淀后的溶液中F-的浓度不低于。
-
(5) “碳化结晶”过程中不能用碳酸铵代替碳酸氢铵,可能的原因是
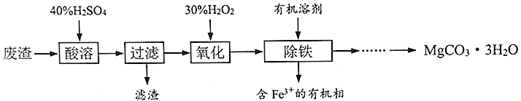
-
(1) “酸溶”过程中加入的H2SO4不宜过量太多,原因是。
-
(2) 加入H2O2 “氧化”时反应的离子方程式为。反应温度一般控制在40℃~50℃,目的是。
-
(3) 用下图所示的实验装置以除去氧化后溶液中的Fe3+。

①实验装置图中仪器A的名称为。
②常用来检验水溶液中的Fe3+是否除净。
-
(4) 请补充完整由(3)中得到的水溶液来制备MgCO3·3H2O的实验方案:边搅拌边,在50℃下干燥,得到MgCO3·3H2O。
[可供选用的试剂:氨水、Na2CO3溶液、蒸馏水;已知该溶液中pH=5.0时Al(OH)3沉淀完全;pH=8.5时Mg(OH)2开始沉淀。]

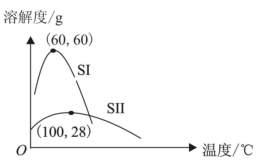
已知:通过合理控制浓缩后溶液的体积可得到外观不同的产品:当浓缩后溶液的体积较多时,易得到灰蓝色针状晶体K2[Cu(C2O4)2]·2H2O(简称SI),反之得到深蓝色片状晶体K2[Cu(C2O4)2]·H2O(简称SII)。
-
(1) 步骤①溶解过程中加入乙醇的目的是。
-
(2) 下列说法错误的是___。A . 步骤②煮沸的目的是除去溶液中的乙醇,防止乙醇与黑色固体发生氧化反应 B . 为提高原料的利用率,可将洗涤后的黑色固体连同滤纸一起加入到热的K2C2O4和KHC2O4混合液中 C . 步骤③为防止抽滤时滤纸破裂,可适当关小水龙头 D . 步骤④、⑤两次洗涤目的相同
-
(3) 移液管可准确移取实验所需的10mL3mol/LNaOH溶液,从下列选项中选出合理操作并排序:取一支10.00mL规格的已润洗移液管,用右手拇指及中指捏住管颈标线以上的地方,左手拿洗耳球轻轻将溶液吸上,。
a.取出移液管,用滤纸拭干移液管下端及外壁
b.当液面上升到标线以上1~2cm时,迅速用右手食指堵住管口
c.将移液管出口尖端与接受器壁接触
d.容器稍稍倾斜,移液管直立,使溶液顺壁流下
e.稍稍松开右手食指,使凹液面与标线相切
f.移液管稍稍倾斜,容器直立,使溶液顺壁流下
-
(4) 步骤⑤为得到较纯净的SI晶体,结合如图两种晶体在不同温度下的溶解度曲线,设计相关实验方案:。
-
(5) 某同学为测定胆矾的利用率(利用率=实际转化为最终产品物质的量/投料物质的量),进行了如下操作:将所得产品用20.00mLNH4Cl—NH3·H2O缓冲溶液溶解,加入指示剂,用0.1000mol/L的EDTA(Na2H2Y)标准溶液滴定至终点(EDTA能与大多数过渡金属元素的离子发生反应,如Cu2++H2Y2-=CuY2-+2H+),消耗EDTA标准溶液20.00mL;则该实验胆矾的利用率是。
选项 | 被提纯物质 | 杂质 | 除杂试剂和操作 |
A | FeCl3溶液 | CuCl2 | 加入适量铁粉,过滤 |
B | NaHCO3固体 | Na2CO3 | 于试管中充分加热 |
C | 铜粉 | 铁粉 | 加入足量氯化铁溶液,过滤、洗涤、烘干 |
D | NaCl固体 | Na2CO3 | 加入过量盐酸,充分反应后,蒸发结晶 |



