物质的分离与提纯 知识点题库
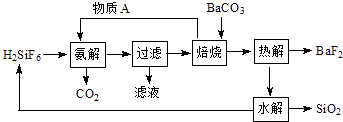
已知:焙烧过程的反应为(NH4)2SiF6+BaCO3 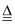 BaSiF6+2NH3↑+CO2↑+H2O↑
BaSiF6+2NH3↑+CO2↑+H2O↑
-
(1) 焙烧的气体产物能恰好完全反应生成物质A,则A的化学式为.
-
(2) 氨解反应为放热反应,且反应能进行完全.该反应需降温冷却的原因为、.
-
(3) 热解的另一产物是含两种元素的气体,该气体水解的化学方程式是.
-
(4) SiO2可用于制作,该物质在信息传输中具有重要应用.
-
(5) 为保持该过程的持续循环,每生成1mol BaF2 , 理论上需补充原料H2SiF6mol.
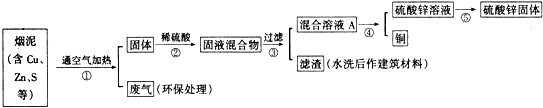
编号 | Cu | Zn | S |
1 | 10.3% | 5.0% | 1.2% |
2 | 11.5% | 4.9% | 1.8% |
3 | 12.4% | 10.3% | 0.9% |
【设计方案】
-
(1) 写出步骤①②中含铜元素的物质发生反应的化学方程式:.
-
(2) 写出本方案中处理废气的方法(用化学方程式表示):.
-
(3) 步骤⑤中所用的操作方法是:.
-
(4) 在步骤④中,可选用试剂从混合溶液A中得到铜.
 B .
B .  C .
C .  D .
D . 
序号 | 物质 | 杂质 | 除杂应选用的试剂或操作方法 |
① | KNO3溶液 | KOH | 加入FeCl3溶液,并过滤 |
② | FeSO4溶液 | CuSO4 | 加入过量铁粉,并过滤 |
③ | H2 | CO2 | 通过盛NaOH溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶 |
④ | NaNO3固体 | CaCO3 | 溶解、过滤、蒸发 |
结构简式 | HOOC-OOH |
溶解性 | 能溶于水,易溶于乙醇 |
特性 | 大约在157℃升华(175℃以上发生分解) |
化学性质 | H2C2O4+Ca(OH)2=CaC2O4↓+2H2O |
HOOC-COOH | |
2KMnO4+5H2C2O4+3H2SO4= K2SO4+2MnSO4+10CO2↑+8H2O |
-
(1) 该组同学欲通过实验验证草酸受热分解产物中的CO2和CO(装置符合气密性要求,其他试剂可选)。
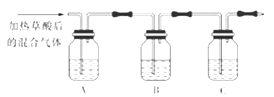
①填写表中空内。
仪器
A
B
C
加入试剂
NaOH溶液
②简述检验CO的实验方法和实验现象。
-
(2) 实验室常用草酸钠测定KMnO4溶液的浓度。
①准确称取2.680g草酸钠,溶于稀硫酸和水制成100.0 mL溶液,每次取20.00mL溶液于锥形瓶中;将待测KMnO4溶液置于(填“酸式”或“碱式”)滴定管中进行滴定。重复上述滴定操作三次,实验数椐如下表所示。待测KMnO4溶液的物质的量浓度为。
滴定前均为
第一次终点
第二次终点
第三次终点
滴定管液面刻度
0.00 mL
20.02mL
21.00mL
19.98mL
②将酸性KMnO4溶液和H2C2O4溶液混合后,发现开始时溶液褪色不明显,但不久后迅速褪色,针对该实验现象,某同学认为KMnO4溶液与H2C2O4溶液的反应是放热反应,导致溶液温度升高,反应速率加快。你猜想还有可能是的影响。若用实验证明你的猜想,除KMnO4溶液、H2C2O4溶液、稀硫酸外,还需要选择的合理试剂是。
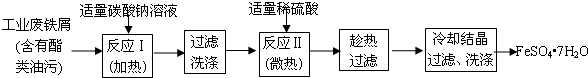
-
(1) 碳酸钠溶液能除去酯类油污,是因为(用离子方程式表示),反应Ⅰ需要加热数分钟,其原因是。
-
(2) 废铁屑中含氧化铁,反应II的离子方程式,判断反应II完成的现象是: 。
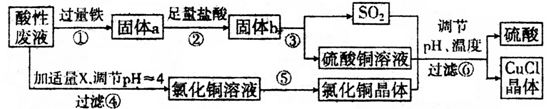
请回答下列问题:
-
(1) 出步驟①中发生的两个主要反应的离子方程式:。
-
(2) 步骤②的操作名称是。
-
(3) 步骤④中所加物质X为。
-
(4) 步骤⑤的操作是。
-
(5) 步骤⑥应调节溶液pH呈酸性,且用乙醇洗涤CuCl晶体,目的是。
-
(6) 在CuCl的生成过程中,可以循环利用的物质是。

 晶体
晶体
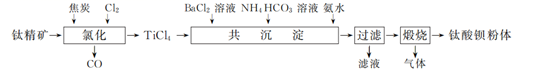
已知:①TiCl4水解生成H2TiO3沉淀;
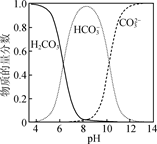
②水溶液中含碳微粒随pH的分布如图所示。
-
(1) “氯化”在800 ℃时进行,其反应的化学方程式为。
-
(2) “共沉淀”时,需控制溶液pH为10~11,其原因是:①;② 。
-
(3) “滤液”中溶质的主要成分为(填化学式)。过滤得到的固体通常用一定浓度的NH4HCO3溶液进行洗涤,其主要原因是。
-
(4) “煅烧”得到的钛酸钡粉体中钡钛质量比
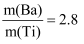 ,钛酸钡粉体中可能含有的杂质为(填化学式)。
,钛酸钡粉体中可能含有的杂质为(填化学式)。
 蒸发溴水获取溴单质
B .
蒸发溴水获取溴单质
B . 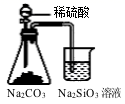 证明碳酸酸性强于硅酸
C .
证明碳酸酸性强于硅酸
C .  比较NaHCO3和Na2CO3的热稳定性
D .
比较NaHCO3和Na2CO3的热稳定性
D . 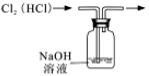 除去氯气中的HCl杂质
除去氯气中的HCl杂质
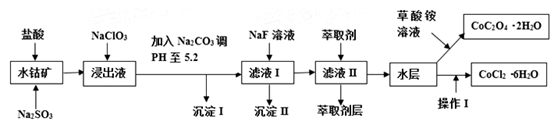
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;
②沉淀I中只含有两种沉淀;
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
|
开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
|
完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
-
(1) 浸出过程中Co2O3发生反应的离子反应方程式为。
-
(2) NaClO3在浸出液中发生的离子反应方程式为。
-
(3) 加入Na2CO3调pH至5.2,目的是;萃取剂层含锰元素,则沉淀II的主要成分为。
-
(4) 操作I包括:将水层加入浓盐酸调整pH为2-3,、、过滤、洗涤、减压烘干等过程。
-
(5) 为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是(回答一条原因即可)。
-
(6) 将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表.
温度范围/℃
固体质量/g
150~210
4.41
290~320
2.41
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为 。
[已知: CoC2O4·2H2O的摩尔质量为183g·mol-1]
下列说法错误的是( )
实验室现有如下试剂及仪器:
试剂:①浓盐酸②饱和食盐水③浓硝酸④浓硫酸⑤碱石灰⑥二氧化锰⑦氯化铵⑧氢氧化钙
仪器:(见图)请完成下列各题:
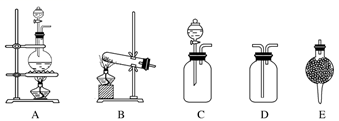
-
(1) 写出制
 的化学方程式:。
的化学方程式:。
-
(2) 用以上仪器(可重复使用)连接成制备纯净
 、
、  的装置,按照前后顺序把图中的编号填入下表中,并写出对应仪器里试剂的编号。
的装置,按照前后顺序把图中的编号填入下表中,并写出对应仪器里试剂的编号。  下列空格不一定填满
下列空格不一定填满 
制

仪器
试剂
制

仪器
试剂
-
(3) 当反应装置里的氨气和氯气的物质的量之比大于时,尾气里一定含有氨气。
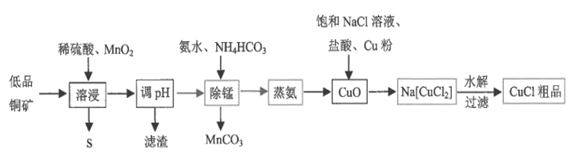
已知:
①氯化亚铜是一种不溶于乙醇,微溶于水的白色晶体,在潮湿空气中易水解、易被氧化。
②几种常见阳离子沉淀的pH如表。
| 阳离子 | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀 | 1.9 | 4.7 | 8.1 |
| 完全沉淀 | 3.2 | 6.7 | 10.1 |
回答下列问题:
-
(1) “溶浸”中MnO2的作用是。
-
(2) 调节pH时应控制的范围是,可以选用的物质是。
A.H2O2 B.CuO C.CuSO4 D.Cu(OH)2
-
(3) 写出生成Na[CuCl2]的化学方程式。
-
(4) 制备CuCl粗品的过程中应隔绝空气,可能的原因是。
-
(5) 称取0.250gCuCl粗品置于预先放入若干玻璃珠和过量FeCl3溶液的锥形瓶中,不断摇动,待粗品完全溶解后,滴加2滴邻菲啰啉指示剂,立即用0.100mol•L-1硫酸高铈[Ce(SO4)2]标准溶液滴定至终点,消耗标准溶液24.50mL。
相关反应为:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+
通过计算可知,该粗品中CuCl的纯度为(保留小数点后一位)。
-
(1) 有下列四组混合物,请选择合适的分离方法进行分离。(填字母)
A.过滤 B.蒸发 C.分液 D.萃取 E.蒸馏 F.升华
①氯化钠溶液提取氯化钠晶体。
②乙醚和苯的混合物。(乙醚和苯沸点分别为34.6℃,80.1℃)
③水和溴苯的混合物。
④氯化钠和碘的固体混合物。
-
(2) 请用下列10种物质的序号填空:只含有极性键的是;既有离子键又有非极性键的是;既有离子键又有极性键的是。
①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2
-
(3) X、Y为前20号元素,能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,且X原子半径大于Y原子,其电子式为:;若XY2为共价化合物,且X、Y均为非金属元素,则XY2的结构式为:。
 、
、  、
、  、
、  中的某几种。将100mL甲气体经过如下图的实验处理,结果得到酸性溶液,而几乎无气体剩余。则甲气体的组成为( )
中的某几种。将100mL甲气体经过如下图的实验处理,结果得到酸性溶液,而几乎无气体剩余。则甲气体的组成为( ) 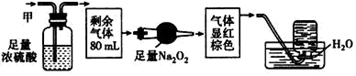
 、
、  、
、  B .
B .  、
、  、
、  C .
C .  、NO、
、NO、  D . NO、
D . NO、  、
、 
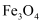 、
、 、
、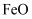 和二氧化硅等。下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁
和二氧化硅等。下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁 流程图:
流程图: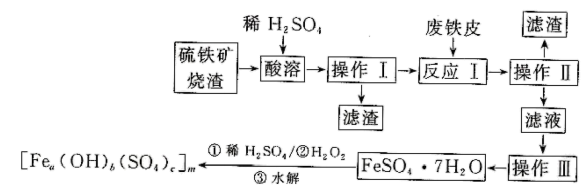
-
(1) 为了加快硫铁矿烧渣“酸溶”速率,常采用的方法是(任写一种)。
-
(2) “操作III”系列操作名称依次为、、过滤和洗涤。
-
(3) “酸溶”过程中
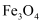 溶解的化学反应方程式为。
溶解的化学反应方程式为。
-
(4) 实验室检验“反应I”已经反应完全的方法是。
-
(5) 加入适量
 的目的是氧化
的目的是氧化 , 写出
, 写出 氧化
氧化 的离子方程式。
的离子方程式。
-
(6) 为了测定聚合硫酸铁
 中a、b、c的比例关系,取一定量的聚合硫酸铁,溶于水配成溶液,分成两等份,其中一份与足量
中a、b、c的比例关系,取一定量的聚合硫酸铁,溶于水配成溶液,分成两等份,其中一份与足量 溶液反应,得到沉淀5.825g,另一份用足量铁粉还原,充分反应后过滤,用
溶液反应,得到沉淀5.825g,另一份用足量铁粉还原,充分反应后过滤,用 酸性
酸性 溶液滴定,消耗酸性
溶液滴定,消耗酸性 , 溶液
, 溶液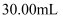 , 请根据数据计算聚合硫酸铁
, 请根据数据计算聚合硫酸铁 中
中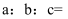 (已知
(已知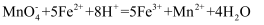 )。
)。
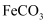 、
、 、
、 中的一种或几种组成,某兴趣小组欲探究其组成,设计探究过程如图所示。
中的一种或几种组成,某兴趣小组欲探究其组成,设计探究过程如图所示。
已知:① 可以与过量的NaOH溶液反应生成
可以与过量的NaOH溶液反应生成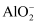 ,
, 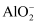 可以与
可以与 反应生成
反应生成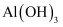 沉淀。
沉淀。
② 是一种酸性氧化物,
是一种酸性氧化物, 难溶于水。
难溶于水。
-
(1) 下列有关
 说法正确的是____。
A . 用石英和焦炭制取粗硅:
说法正确的是____。
A . 用石英和焦炭制取粗硅: B . 造月球探测器中的瞄准镜时使用的光导纤维,其主要成分是
B . 造月球探测器中的瞄准镜时使用的光导纤维,其主要成分是 C . 月球探测器使用的硅太阳能电池板,其主要成分是
C . 月球探测器使用的硅太阳能电池板,其主要成分是 D .
D .  、石灰石和纯碱是制备玻璃的原料
E . 氢氟酸雕刻玻璃发生的离子反应:
、石灰石和纯碱是制备玻璃的原料
E . 氢氟酸雕刻玻璃发生的离子反应:
-
(2) 写出反应④的离子方程式。
-
(3) 反应③没有沉淀生成,说明矿石中不存在(填化学式),为了达到此目的,(填“能”或“否”)将反应②中NaOH溶液改用
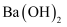 溶液,说明理由。
溶液,说明理由。
-
(4) 该矿石和
 溶液反应的离子方程式为。
溶液反应的离子方程式为。
-
(5) 工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的
 混合循环通入反应池中,目的是。
混合循环通入反应池中,目的是。
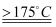 CO2↑+CO↑+H2O
CO2↑+CO↑+H2O


