物质的分离与提纯 知识点题库

下列相关叙述正确的是( )
 ×100%
D . 合金样品中Al的质量分数为
×100%
D . 合金样品中Al的质量分数为  ×100%
×100%
原物质 | 所含杂质 | 除杂试剂 | 主要操作方法 | |
A | HNO3溶液 | H2SO4 | BaCl2溶液 | 过滤 |
B | CO2 | SO2 | 酸性KMnO4溶液、浓硫酸 | 洗气、干燥 |
C | SiO2 | Al2O3 | 稀盐酸 | 过滤 |
D | C2H5OH | CH3COOH | CaO | 蒸馏 |
-
(1) Na2SO4溶液(Na2CO3):所加试剂离子方程式
-
(2) O2(CO2):所加试剂离子方程式
-
(3) FeSO4溶液(CuSO4):所加试剂离子方程式
-
(4) Fe(Al)所加试剂离子方程式.
混合物 | 试剂 | 分离方法 | |
A | 苯(苯酚) | 溴水 | 过滤 |
B | 甲烷(甲醛) | 水、浓硫酸 | 洗气 |
C | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 蒸馏 |
D | 淀粉胶体(氯化钠溶液) | 蒸馏水 | 萃取 |

-
(1) 固体A的成分是(填化学式).
-
(2) 溶液B中的金属阳离子有.
-
(3) B→D反应的离子方程式是.
-
(4) 试剂G是(填名称).
-
(5) 溶液E焰色反应呈黄色,试剂H是.

据此回答下列问题:
-
(1) KAl(SO4)2的电离方程式.
-
(2) 根据上述框图反应关系,写出下列C、E所含物质的化学式沉淀C.
-
(3) 写出①、②两步的化学反应方程式是
①.

-
(1) 写出仪器A、C、E的名称
-
(2) 分离以下混合物应该主要选用什么仪器?(填字母符号)
食用油和酒精: 汽油和水:.

已知:①有关氢氧化物开始沉淀和沉淀完全的pH如表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 沉淀完全的pH | 3.6 | 9.7 | 9.2 |
②常温下CaF2难溶于水,微溶于无机酸
-
(1) 操作B中需调节pH范围为,使用Na2CO3调节pH过程中发生的反应有。实验人员发现温度不同时,镍的浸出率不同,浸出率与温度的关系如图所示。请解释当温度高于70℃时,浸出液中Ni2+含量降低的原因。

-
(2) 下列说法正确的是____A . 为提高酸浸效率,可充分搅拌或适当提高硫酸浓度 B . 操作A中应持续通入过量H2S气体使杂质Cu2+彻底沉淀 C . 浸出渣的主要成分为CaSO4•2H2O和BaSO4 D . 为得到副产品胆矾,应蒸发浓缩至出现大量晶体,用玻璃纤维代替滤纸进行趁热过滤
-
(3) 电解过程中,Cl-在阳极被氧化为ClO- , 但是反应前后溶液中Cl-浓度不变。写出生成沉淀反应的离子方程式。
-
(4) 操作C加入NaF后如何证明沉淀完全。
-
(5) 工业上也可通过将草酸镍(NiC2O4•2H2O)在热空气中干燥脱水,再在高温下煅烧三小时制得Ni2O3 , 同时获得混合气体。草酸镍受热分解的化学方程式为。
| 选项 | 物质 | 选用试剂(过量) | 操作方法 |
| A | CO(CO2) | NaOH溶液 | 洗气、浓硫酸干燥 |
| B | FeSO4溶液(CuSO4) | 铁粉 | 过滤 |
| C | NaBr溶液(Br2) | 四氯化碳 | 萃取、分液 |
| D | KNO3(KCl) | AgNO3溶液 | 溶解、过滤、蒸发、结晶 |
 形式存在,采用以下工艺流程可由黏土钒矿制备V2O5。
形式存在,采用以下工艺流程可由黏土钒矿制备V2O5。 已知:V2O5在碱性条件下以VO  形式存在。
形式存在。

以下说法正确的是( )
 ,至少需要1molKClO3
B . 滤液1中主要的阴离子有[Al(OH)4]-和VO
,至少需要1molKClO3
B . 滤液1中主要的阴离子有[Al(OH)4]-和VO  C . “煅烧”时需要的仪器主要有蒸发皿、玻璃棒、三脚架、酒精灯
D . “煅烧”时,NH4VO3受热分解:2NH4VO3
C . “煅烧”时需要的仪器主要有蒸发皿、玻璃棒、三脚架、酒精灯
D . “煅烧”时,NH4VO3受热分解:2NH4VO3  V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O

下列说法正确的是( )
-
(1) Ⅰ.海带中碘元素的确定
海带
 海带灰
海带灰 
 海带灰浸取液
海带灰浸取液取海带灰浸取液
 ,加入稀硫酸约
,加入稀硫酸约  、5%的
、5%的  溶液约
溶液约  ,然后加入
,然后加入  约
约  ,振荡后静置,可以观察到,证明海带中含有碘元素,该反应的离子方程式为。
,振荡后静置,可以观察到,证明海带中含有碘元素,该反应的离子方程式为。 -
(2) Ⅱ.海带提碘
海带灰浸取液
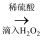 含I2的水溶液
含I2的水溶液  碘的有机溶液→晶体碘
碘的有机溶液→晶体碘若向
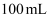 碘水L中加入
碘水L中加入  ,充分振荡、静置,此时碘在
,充分振荡、静置,此时碘在  中的物质的量浓度是水中的86倍,则萃取效率为%(结果保留小数点后两位)(萃取效率
中的物质的量浓度是水中的86倍,则萃取效率为%(结果保留小数点后两位)(萃取效率  )。
)。 -
(3) 萃取实验中,若要使碘尽可能地完全转移到
 中,可以采取的操作是。
中,可以采取的操作是。
-
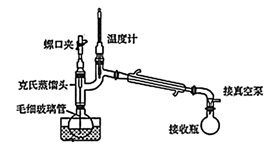
(4) 某同学采取减压蒸馏(装置如图),可以很快完成碘和四氯化碳的分离,减压蒸馏时使用了克氏蒸馏头,克氏蒸馏头比普通蒸馏头增加了一个弯管,弯管的主要作用是。
-
(5) Ⅲ.海带中碘含量的测定
若称取干海带
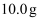 ,经灼烧、浸取、
,经灼烧、浸取、  氧化等过程后配制成
氧化等过程后配制成 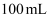 溶液,移取
溶液,移取 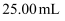 于锥形瓶中,用
于锥形瓶中,用  标准溶液滴定,待溶液由黄色变为浅黄色时,滴加两滴淀粉指示剂,继续滴定至蓝色刚好褪去,且半分钟内无变化,即为终点,平行滴定3次,记录所消耗的
标准溶液滴定,待溶液由黄色变为浅黄色时,滴加两滴淀粉指示剂,继续滴定至蓝色刚好褪去,且半分钟内无变化,即为终点,平行滴定3次,记录所消耗的  溶液的平均体积为
溶液的平均体积为  ,计算海带中含碘的质量分数为%(结果保留小数点后两位)(已知
,计算海带中含碘的质量分数为%(结果保留小数点后两位)(已知  )。若滴定结束读数时俯视刻度线,会导致测定结果(填“偏高”“偏低”或“不影响”)。
)。若滴定结束读数时俯视刻度线,会导致测定结果(填“偏高”“偏低”或“不影响”)。

-
(1) 焙烧除铁反应:4(NH4)2SO4+Fe2O3
 2NH4Fe(SO4)2+3H2O+6A↑(Al2O3少部分发生类似反应)。气体A的化学式为。
2NH4Fe(SO4)2+3H2O+6A↑(Al2O3少部分发生类似反应)。气体A的化学式为。
-
(2) 操作①的名称是,操作①后,需洗涤固体D表面吸附的离子,判断固体D是否洗涤干净的实验方法是:取最后一次洗涤后的浸出液于试管中,滴加KSCN溶液,观察到,说明已洗涤干净。
-
(3) 固体D加稀硫酸反应的离子方程式为。
-
(4) 操作③的具体步骤是蒸发、、过滤、洗涤、干燥。
-
(5) 固体E与NaOH固体焙烧可制备防火材料,下列装置适合的是(填字母编号)。
a.
 b.
b. c.
c. d.
d.
-
(6) 不计过程中的损失,投入5t铝土矿,理论上可制得明矾t(明矾的相对分子质量为474)。

物质 | 熔点/℃ | 沸点/℃ | 密度/g.cm-3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
实验步骤如下:
ⅰ.取100mL烧杯,用20mL浓硫酸与足量浓硝酸配制混和酸,将混合酸小心加入B中。把18mL(15.84 g)苯加入A中。
ⅱ.向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。在50~60℃下发生反应,直至反应结束。
ⅲ.将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2 , 进行蒸馏纯化,收集205~210℃馏分,得到纯硝基苯18g。
回答下列问题:
-
(1) 图中装置C的作用是。
-
(2) 制备硝基苯的化学方程式。
-
(3) 叙述配制混合酸操作:。
-
(4) 为了使反应在50℃~60℃下进行,常用的方法是。反应结束并冷却至室温后A中液体就是粗硝基苯,粗硝基苯呈黄色的原因是(用化学方程式说明),除去该有色物质选择的试剂是,分离提纯的方法为。
-
(5) 在洗涤操作中,第二次水洗的作用是。
-
(6) 在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用水直形冷凝管的原因是。

已知:①锌灰的主要成分为ZnO,还含有CuO、PbO、MnO和FeO;
②“滤渣2”的主要成分为Fe(OH)3和MnO(OH)2;
③已知ZnSO4的溶解度随温度变化如图。

请回答下列问题:
-
(1) “滤渣1”的主要成分为 。
-
(2) “氧化”时,Fe2+被氧化的离子方程式为
-
(3) 操作a涉及以下操作:a.在60℃蒸发溶剂;b.在100℃蒸发溶剂;c.蒸发至溶液出现晶膜,停止加热;d.冷却至室温;e.过滤。
以上操作的正确顺序为:(上述操作可重复使用)。
-
(4) ZnSO4·7H2O产品的纯度可用滴定法分析测定。下列关于滴定分析,正确的是____。
 A . 如图中,应将凡士林涂在旋塞的b端和旋塞套内的d端 B . 滴定前,滴定管须用标准溶液润洗 C . 将标准溶液装入滴定管时,应借助漏斗转移防止溅出 D . 滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转 E . 滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡,则测得的体积比实际消耗的小
A . 如图中,应将凡士林涂在旋塞的b端和旋塞套内的d端 B . 滴定前,滴定管须用标准溶液润洗 C . 将标准溶液装入滴定管时,应借助漏斗转移防止溅出 D . 滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转 E . 滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡,则测得的体积比实际消耗的小 -
(5) 工业上采用惰性电极电解ZnSO4溶液可实现湿法炼锌,电解过程中的离子方程式为。
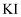 溶液,用汽油萃取
B . 酸性
溶液,用汽油萃取
B . 酸性  溶液既可鉴别乙烷和乙烯,又可除去乙烷中少量的乙烯
C . 乙烷中有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷
D . 己烷中溶有溴单质,可加足量氢氧化钠溶液,完全反应后分液
溶液既可鉴别乙烷和乙烯,又可除去乙烷中少量的乙烯
C . 乙烷中有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷
D . 己烷中溶有溴单质,可加足量氢氧化钠溶液,完全反应后分液



