实验装置综合 知识点题库
-
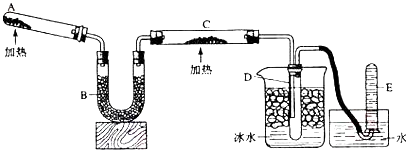
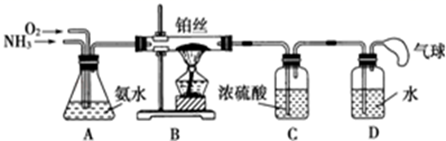
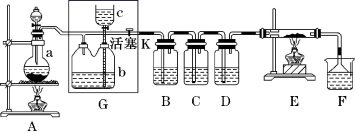
(1) A中实验室制备氨气化学方程式是.
-
(2) B中加入的物质是,其作用是.
-
(3) 实验时C中观察到的现象是,该反应中氨的作用剂.(填氧化或还原)
-
(4) E中收集到的气体是.
-
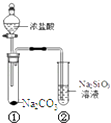
(1) 甲同学用此装置验证物质的氧化性:KMnO4>Cl2>Br2 , 则a中加浓盐酸,b中加KMnO4 , c中加溶液.将浓盐酸滴入b中后,发生反应的离子方程式是;b中反应结束后再向c中加入少量CCl4 , 振荡静置后观察到c中的现象为.
-
(2) 乙同学用此装置制少量溴苯,a中盛液溴,b中为铁屑和苯,c中盛水.将液溴滴入b中后,发生反应的化学方程式是:.能证明该反应是取代反应,而不是加成反应的操作和现象
 B .
B . 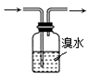 C .
C . 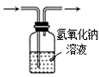 D .
D . 
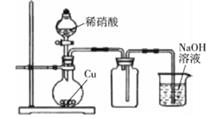 实验室制备少量NO
B .
实验室制备少量NO
B . 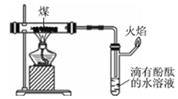 煤的干馏并验证部分产物
C .
煤的干馏并验证部分产物
C .  探究乙醇的催化氧化
D .
探究乙醇的催化氧化
D . 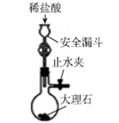 实验室制备少量CO2
实验室制备少量CO2
-
(1) 实验室制备NH3 , 下列方法中适宜选用的是(填序号)。
①固态氯化铵与熟石灰混合加热
②固态氯化铵加热分解
③碱石灰中滴加浓氨水
④氯化铵溶液与氢氧化钠溶液共热
-
(2) 装置B中发生反应的化学方程式为;
-
(3) 装置C的作用是;装置C中的现象;为确保装置D中尽可能多地生成HNO3 , 所通入O2和NH3的体积比应大于;
-
(4) 装置D中发生的反应化学方程式为。(请分步写出化学方程式)
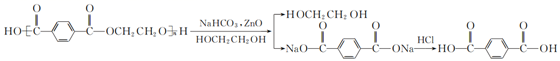
实验步骤如下:
步骤1:在题图1所示装置的四颈烧瓶内依次加入洗净的矿泉水瓶碎片、氧化锌、碳酸氢钠和乙二醇,缓慢搅拌,油浴加热至180 ℃,反应0.5 h。
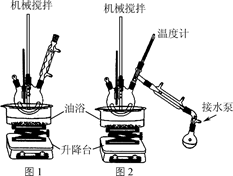
步骤2:降下油浴,冷却至160 ℃,将搅拌回流装置改为图2所示的搅拌蒸馏装置,水泵减压,油浴加热蒸馏。
步骤3:蒸馏完毕,向四颈烧瓶内加入沸水,搅拌。维持温度在60 ℃左右,抽滤。
步骤4:将滤液转移至烧杯中加热煮沸后,趁热边搅拌边加入盐酸酸化至pH为1~2。用砂芯漏斗抽滤,洗涤滤饼数次直至洗涤滤液pH=6,将滤饼摊开置于微波炉中微波干燥。
请回答下列问题:
-
(1) 步骤1中将矿泉水瓶剪成碎片的目的是。
-
(2) 步骤2中减压蒸馏的目的是,蒸馏出的物质是。
-
(3) 抽滤结束后停止抽滤正确的操作方法是。若滤液有色,可采取的措施是。
-
(4) 该实验中,不采用水浴加热的原因是。
-
(1) 若A中烧瓶中的固体为MnO2 ,液体为浓盐酸 ,则A中发生反应的化学方程式为。
-
(2) G中b瓶内宜加入的液体是 ,怎样检验装置G的气密性。
-
(3) 实验开始后B中的现象是 ,C中的现象是。
-
(4) 装置E中硬质玻璃管内盛有炭粉 ,若E中发生氧化还原反应 ,其产物为二氧化碳和氯化氢 ,写出E中反应的化学方程式。
-
(5) 在F中 ,紫色石蕊试液的颜色由紫色变为红色 ,再变为无色,其原因是。
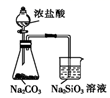
| A | B | C | D |
| | | | |
| 验证碳酸的酸性强于硅酸 | 分离苯和酒精 | 制取少量O2 | 收集少量NO2气体 |

已知: BCl3 的熔点为- 107.3℃ 沸点为 12.5 ℃ , 遇水水解生成 H3BO3和HCl。
下列说法错误的是( )
查阅资料,有关信息如下:
①制备反应原理:C2H5OH + 4Cl2 → CCl3CHO + 5HCl
可能发生的副反应:C2H5OH + HCl → C2H5Cl + H2O、CCl3CHO + HClO → CCl3COOH + HCl
②相关物质的部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
回答下列问题:
-
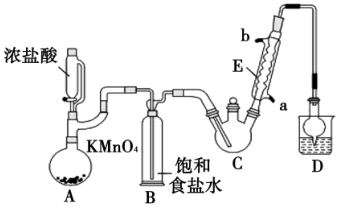
(1) 仪器E的名称是,冷凝水的流向是口进水(填“a”或“b")。
-
(2) 有同学认为应在B、C之间加一干燥装置,理由是。
-
(3) 装置C应控制反应温度在70℃左右,可采用加热的方法。
-
(4) 装置D干燥管的作用为导气、,装置D烧杯中的试剂是。
-
(5) 反应结束后,从C中的混合物中分离出CCl3COOH的方法是(填名称)。
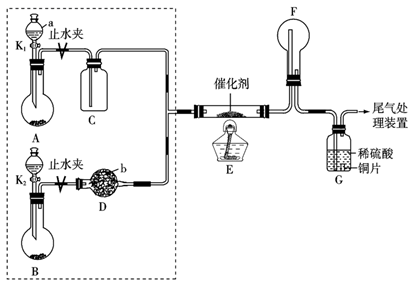
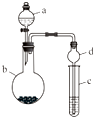
已知装置A、B可选药品:浓氨水、H2O2、蒸馏水、生石灰、MnO2。
-
(1) 仪器b的名称为。
-
(2) 装置A烧瓶中固体的作用为_______(填字母)。A . 催化剂 B . 氧化剂 C . 还原剂 D . 反应物
-
(3) 仪器b中盛放的试剂可以是_______(填字母)。A . 浓硫酸 B . 碱石灰 C . 五氧化二磷 D . 硫酸铜
-
(4) 装置E中发生反应的化学方程式为。
-
(5) 甲、乙两同学分别按上述装置进行实验,一段时间后:
①甲观察到装置F中只有白烟生成,白烟的成分是(写化学式)。
②乙观察到装置F中有红棕色气体,装置G中溶液变成蓝色。用离子方程式解释装置G中溶液变成蓝色的原因:。
-
(6) 尾气处理装置所需的液体试剂是。
-
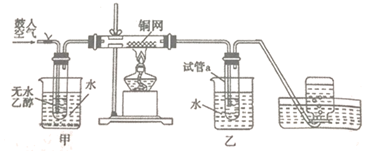
(1) 装有铜网的玻璃管中发生反应的化学方程式为;
-
(2) 甲、乙两处水浴作用不相同。甲中装的是(选填“热水”、“冷水”);乙的作用是;
-
(3) 若试管a中收集到的混合液体可使紫色石蕊试液变红色,则可通过(填实验操作名称)的方法获得乙醛。
 CH3COO(CH2)3CH3+H2O,装置如图所示(夹持装置已略去),实验步骤如下:
CH3COO(CH2)3CH3+H2O,装置如图所示(夹持装置已略去),实验步骤如下: 
I.向100mL反应容器X中,加18.5g正丁醇,16.8g 冰醋酸,1gKHSO4 , 混匀,加2粒沸石。接上冷凝管和分水器。
II.加热反应开始后,控制回流速度1~ 2滴/s,大约40 min后,反应完成,停止加热。
III.分离提纯产品。过滤回收KHSO4 , 将滤液和分水器分出的酯层一起倒入分液漏斗中,用10 mL水洗涤; ……蒸馏得到产品29.0 mL。
已知:
| 名称 | 相对分子质量 | 溶解性 | 密度(g/cm3) | 沸点(℃) |
| 正丁醇 | 74 | 稍溶于水和易溶于有机溶剂 | 0.81 | 117.7 |
| 冰醋酸 | 60 | 能溶于水和有机溶剂 | 1.05 | 117.9 |
| 乙酸正丁酯 | 116 | 难溶于水 | 0.90. | 126.5 . |
回答下列问题:
-
(1) 图中仪器X的名称是,KHSO4的作用是。
-
(2) 用过量乙酸的目的是。
-
(3) 本实验中分水器的作用是。 实验中需先在分水器中加水,使水面稍低于支管口1~2cm,并保持水面上仅有很浅一层油层存在,直至反应完成。这样操作的目的是。
-
(4) 步骤III中第一次水洗主要除去的是。步骤III“……”。处还需要经过以下一系列的操作提纯,其正确的顺序是。
a.再用10mL水洗涤; b.用无水硫酸镁干燥;
c.用10 mL 10%Na2CO3洗涤; d.过滤
-
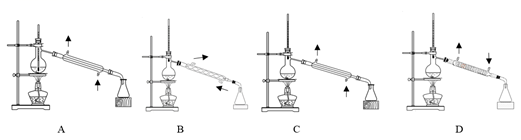
(5) 下列蒸馏装置最合适的是(填选项字母) ;本实验中乙酸正丁酯的产率为
-
(1) Ⅰ.实验室利用下列装置制备氯气并验证氯气是否具有漂白性,回答下列问题:
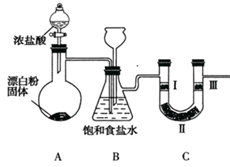
装置B中饱和食盐水的作用是;同时装置B也是安全瓶,监测实验进行时装置C是否发生堵塞,请写出发生堵塞时装置B中的现象:。
-
(2) 装置C的实验目的是验证氯气是否具有漂白性,为此装置C中Ⅰ、Ⅱ、Ⅲ处依次放入(填字母)。
a
b
c
d
Ⅰ
干燥的
有色布条
干燥的
有色布条
湿润的
有色布条
湿润的
有色布条
Ⅱ
碱石灰
硅胶
浓硫酸
无水氯化钙
Ⅲ
湿润的
有色布条
湿润的
有色布条
干燥的
有色布条
干燥的
有色布条
-
(3) Ⅱ.FeCl3是重要的化工原料,主要用于污水处理、印染、建筑、冶金、玻璃、五金蚀刻、有机工业等方面的应用。无水FeCl3在300℃以上升华,遇潮湿空气极易潮解。实验室利用纯净干燥的氯气制备无水FeCl3可能用到的实验仪器如下:
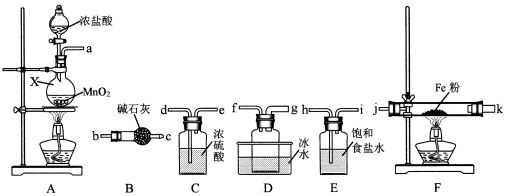
写出A中反应的离子方程式:
-
(4) 仪器的连接顺序为a→→ →→→j→k→→→→
-
(5) B中碱石灰的作用是
-
(6) 用碘量法测定所得无水氯化铁的质量分数:称取m克无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶中,用蒸馏水定容;取出10mL,加入稍过量的KI溶液(2Fe3++2I-=2Fe2++I2),充分反应后,用cmol/L的Na2S2O3溶液进行滴定(已知:
 ),终点时消耗VmLNa2S2O3溶液.则样品中氯化铁的质量分数为(用含c、V、m的代数式表示)。
),终点时消耗VmLNa2S2O3溶液.则样品中氯化铁的质量分数为(用含c、V、m的代数式表示)。
-
(1) I.请回答下列问题:
常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图。1 mol 硼酸(H3BO3)晶体中含有 mol 氢键。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:。
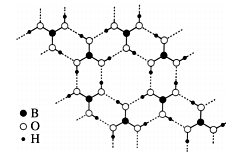
-
(2) 比较酸性的相对强弱:H2SO4HClO4 (填“>”“=”或“<”),已知能发生反应:H2SO4(浓)+NaClO4
 HClO4+NaHSO4 , 说明该反应能发生的理由。
HClO4+NaHSO4 , 说明该反应能发生的理由。
-
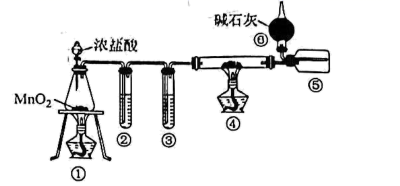
(3) Ⅱ.氮化铝(AlN)是一种性能优异的新型材料,在许多领域有广泛应用,前景广阔。某化学小组模拟工业制氮化铝原理欲在实验室制备氮化铝。查阅资料:①实验室用饱和NaNO2溶液与NH4Cl溶液共热制N2:NaNO2+NH4Cl
 NaCl+N2↑+2H2O;②工业制氮化铝:Al2O3+3C+N2
NaCl+N2↑+2H2O;②工业制氮化铝:Al2O3+3C+N2  2AlN+3CO,氮化铝在高温下能水解。
2AlN+3CO,氮化铝在高温下能水解。 氮化铝的制备
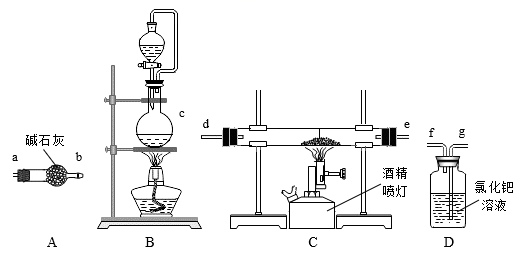
①实验中使用的装置如上图所示,请按照氮气流方向将各仪器接口连接:c→。 (根据实验需要,上述装置可使用多次)
②D装置内氯化钯溶液的作用可能是。
-
(4) AlN粉末会缓慢发生水解反应,粒径为100 nm的AlN粉末水解时溶液pH的变化如下图所示。

①AlN粉末水解的化学方程式是。
②相同条件下,请在图中画出粒径为40 nm的AlN粉末水解的变化曲线。
-
(1) 图1装置A中,烧瓶内药品可选用

-
(2) 实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为。
-
(3) 该实验缺少尾气吸收装置,图2中不能用来吸收尾气的装置是(填装置序号)。
-
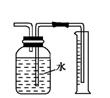
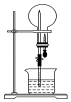
(4) 实验室还可用图3所示装置制备氨气,反应化学方程式为。用圆底烧瓶收集干燥的氨气,用图4装置进行喷泉实验,挤压胶头滴管时,可以得到红色喷泉,原因是(用化学方程式和适当的文字来说明)。
-
(5) 图4装置中,若将胶头滴管中的水和烧杯中滴有酚酞的水换成下列选项的溶液,烧瓶中的气体变换成下列选项中的气体,不能形成喷泉实验现象的组合是____。
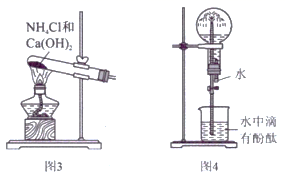 A . 水、CO2 B . HCl溶液、NH3气体 C . NaOH溶液、HCl气体 D . NaOH溶液、CO2气体
A . 水、CO2 B . HCl溶液、NH3气体 C . NaOH溶液、HCl气体 D . NaOH溶液、CO2气体 -
(6) 氨气极易溶于水,若标准状况下,将5.6L的氨气溶于水配成1L溶液,所得溶液的物质的量浓度为 mol∙L−1

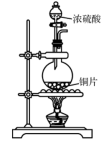 B . 净化
B . 净化
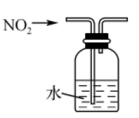 C . 分离乙醇与乙酸
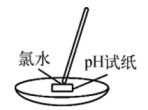
C . 分离乙醇与乙酸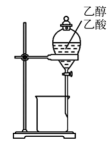 D . 测氯水的
D . 测氯水的