氧化还原反应方程式的配平 知识点题库
 →Mn2+ + NO3- + H2O。下列叙述中正确的是 ( )
→Mn2+ + NO3- + H2O。下列叙述中正确的是 ( )
 中的粒子是OH-
中的粒子是OH-
-
(1) 该反应中的X离子是,还原产物是.
-
(2) 该反应的离子方程式为:.
-
(3) 如反应转移了0.2mol电子,则反应的NO2﹣的物质的量为.
-
(4) 实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,该反应的化学方程式为:.
-
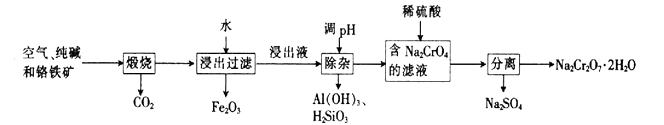
(1) 亚铬酸亚铁[Fe(CrO2)2]中Cr的化合价是。
-
(2) 煅烧生成Na2CrO4的化学方程式为。
-
(3) 酸化滤液Na2CrO4 时,不选用赴酸的原因是,从平衡角度分析酸化的原理:。
-
(4) 该工艺中某种产物可以再利用,该物质的化学式为。
-
(5) 采用石墨电极电解Na2CrO4溶液,可实现Na2CrO4→Na2Cr2O7的转化,其原理如图所示。
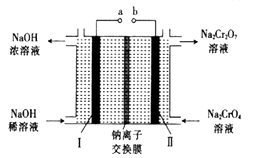
①写出Ⅰ电极的电极反应式。
②当Na2CrO4 转化为1mal Na2Cr2O7时,理轮上Ⅱ电极上转移电子的物质的量为。
-
(6) 称取2.500g重铬酸钠晶体试样,加入蒸馏水配制成250ml 溶液,从中取出25.00mL于碘量瓶中,向其中加入10mL2mol·L-1 H2SO4 溶液和足量碘化钾(铬的还原产物为Cr3+),放于暗处5 min。然后加入100mL水,加入3mL淀粉指示剂,用0.120mol·L-1的Na2S2O3标准溶液进行滴定(发生反应:I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是。
②若实验中共用去40.00mL,Na2S2O3标准溶液。则所得产品的纯度为(设整个过程中其他杂质不参如反应)(保留3 位有效数字)。
附表:不同温度下若干常见钾的化合物的溶解度(单位:g/(100g H2O))
化学式 | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 100℃ |
CH3COOK | 256 | 283 | 324 | 350 | 381 | |
K2SO4 | 11.1 | 13 | 14.8 | 18.2 | 21.4 | 24.1 |
KCl | 34.2 | 37.2 | 40.1 | 45.8 | 51.3 | 56.3 |
KMnO4 | 6.34 | 9.03 | 12.6 | 22.1 | ||
K2CO3 | 111 | 114 | 117 | 127 | 140 | 156 |
-
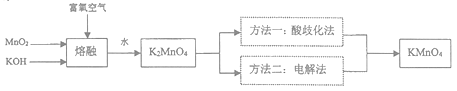
(1) “熔融”时,可用作坩锅材质的是________________(填序号)。A . 氧化铝 B . 陶瓷 C . 氧化镁 D . 石英
-
(2) 写出MnO2和KOH熔融物中通入富氧空气时获得K2MnO4的化学方程式。
-
(3) “酸歧化法”是在pH<6的情况下K2MnO4即可转化为MnO2和KMnO4 , 过滤除去MnO2 , 将滤液经过蒸发浓缩、趁热过滤得到KMnO4粗晶体,再经过重结晶获得较纯净的KMnO4晶体;
①根据表中的溶解度数据以及上述操作的特点,“酸歧化法”不适宜选择的酸性物质是。
A.稀硫酸
B.醋酸
C.稀盐酸
D.二氧化碳
②“蒸发浓缩”时,温度需控制在70℃,适宜的加热方式是。
③根据相关方程式,计算“酸歧化法”的理论产率为。
-
(4) “电解法”克服了“酸歧化法”理论产率偏低的问题,同时副产品KOH可用于软锰矿的焙烧。电解法制备高锰酸钾的实验装置示意图如下(图中阳离子交换膜只允许K+离子通过)
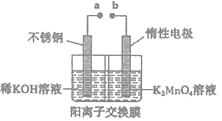
①a为极 (填“正”或“负”),右室发生的电极反应方程式为。
②若电解开始时阳极区溶液为1.0L 0.40 mol·L-1K2MnO4溶液,电解一段时间后,右室中n(K)/m(Mn)为6:5,阴极区生成KOH的质量为。
 =
= 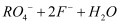 ,由此可知在
,由此可知在  中元素R的化合价是( )
中元素R的化合价是( )
-
(1) 绿矾除用铁粉与硫酸反应生成外,工业上还可用空气、水、黄铁矿(主要成分为FeS2)来制取。已知该反应除生成硫酸亚铁,还生成一种中学化学常见的强酸,试写出该反应的化学方程式: 。
-
(2) 试配平:Fe2++Cr2O72-+H+=Fe3++Cr3++H2O
-
(3) 若该废水经处理后Cr3+的含量为1×10−2 mol·m−3 , 理论上83.4 kg绿矾可以处理该废水吨(已知废水的密度为1 g·cm−3)。
-
(1) 1mol H2SO4中含有个硫原子,mol O。
-
(2) 写出下列物质在水溶液中的电离方程式
HCl:NaHSO4:
-
(3) 写出下列化学反应的方程式
呼吸面具中过氧化钠与二氧化碳反应的化学方程式
氢氧化亚铁白色沉淀迅速变为灰绿色,最终变为红褐色的反应的化学方程式
印刷电路板处理时铜与氯化铁溶液反应的离子方程式
-
(4) 配平下列方程式:
I-+IO3-+ H+—I2+H2O
NH4ClO4——N2↑+O2↑+HCl+H2O
-
(5) 用单线桥法或双线桥法表示该反应转移电子的方向和数目并填空:
Cu+4 HNO3(浓)= Cu(NO3)2+ 2 NO2↑+ 2H2O
HNO3的作用是,发生氧化反应,氧化产物是。
-
(1) 氧、氟、氮三种元素都可形成简单离子,它们的离子半径最小的是(填离子符号),硅元素在元素周期表中的位置是。CO2和SiO2是同一主族元素的最高正价氧化物,常温下CO2为气体,SiO2为高熔点固体。请分析原因:。
-
(2) 比较硫和氯性质的强弱。热稳定性H2SHCl(选填“<”、“>”或“=”,下同);酸性:HClO4H2SO4。用一个离子方程式说明氯元素和硫元素非金属性的相对强弱:。
-
(3) 红酒中添加一定量的SO2 可以防止酒液氧化,这利用了SO2 的性。若将SO2气体通入H2S水溶液中直至过量,下列表示溶液的pH随通入SO2气体体积变化的示意图正确的是(填序号)。
已知NaHSO3溶液呈酸性,而HSO
 既能电离又能水解。则在NaHSO3溶液中c(H2SO3)c(SO
既能电离又能水解。则在NaHSO3溶液中c(H2SO3)c(SO  )(选填“<”、“>”或“=”) 。
)(选填“<”、“>”或“=”) 。 -
(4) 亚硫酸钠和碘酸钾在酸性条件下反应生成硫酸钠、硫酸钾、碘和水,配平该反应方程式
_Na2SO3+_KIO3+_H2SO4
 _Na2SO4+_K2SO4+_I2+_ H2O
_Na2SO4+_K2SO4+_I2+_ H2O
-
(1) 储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,其反应式为:C+K2Cr2O7+H2SO4——CO2+K2SO4+Cr2(SO4)3+H2O(未配平)
①配平上述方程式:
②上述反应中氧化剂是(填化学式,下同),氧化产物是。
③H2SO4在上述发应中表现出来的性质是(填序号)
a.氧化性 b.氧化性和酸性 c.酸性 d.还原性和酸性
-
(2) 由下列6种物质:Na2SO4、Na2SO3、K2SO4、I2、H2SO4、KIO3组成一个氧化还原反应,请回答下列问题:
①将这6种物质分别填入下面对应的横线上,组成化学方程式并配平:
+ → I2 + + +H2O
②用双线桥表示该反应中电子转移的方向和数目:
-
(1) ①写出实验室中制取氯气的离子方程式;
②已知KMnO4与浓盐酸反应的化学方程式如下,该反应也可以用来制取氯气:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,15.8g KMnO4能和 gHCl发生上述反应、其中有molHCl被氧化、产生的Cl2在标准状况下的体积为L;
③实验室还可以利用如下反应制取氯气:KClO3+6HCl(浓)= KCl+3Cl2↑+3H2O。若制取标准状况下6.72L氯气,反应过程中转移电子的物质的量为;
-
(2) 常温下,氯气与烧碱溶液反应得“84”消毒液,NaClO 是“84”消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用 :
①浸泡衣物时加入“84”消毒液在空气中放置一段时间漂白效果更好,原因用离子方程式表示为:;(已知酸性:H2CO3 >HClO>
 )
) ②某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO和NaClO3的混合溶液,经测定ClO-与
 的个数比为1∶3,写出该反应的化学方程式:;
的个数比为1∶3,写出该反应的化学方程式:; -
(3) 世界卫生组织将ClO2定为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。消毒效率是用单位质量的消毒剂得电子数来表示的,ClO2作消毒剂时和氯气一样,还原产物均为Cl- , ClO2的消毒效率是氯气的倍。
-
(1) 一种由海绵铜(Cu)为原料制备CuCl的工艺流程如下:
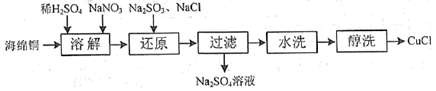
①“溶解”步骤发生反应的离子方程式为;
②潮湿的CuCl在空气中被氧化的化学反应方程式为;
③已知常温下Cu(OH)2溶度积常数Ksp=2×10-20要使c(Cu2+)=0.2 mol·L-1的硫酸铜溶液中的铜离子沉淀比较完全(使铜离子浓度变为原来的千分之一)则应调节溶液pH为以上。
-
(2) 次磷酸(H3PO2)是一元中强酸,可用于作金属表面处理剂。
①向Ba(H2PO2)2溶液中加入硫酸可以制取H3PO2 , 写出反应的化学方程式:;
②H3PO2可将溶液中的Ag+还原为银,从而用于化学镀银,反应同时生成P元素最高价氧化物对应的水化物。在该过程中,氧化剂与还原剂的物质的量之比为:;
③NaH2PO2的水溶液呈弱碱性,用离子方程式说明原因:。
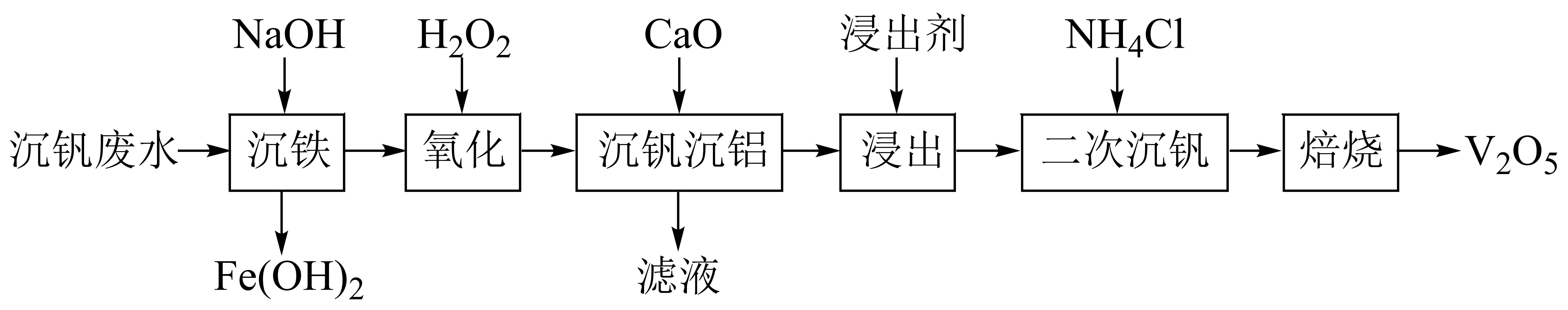
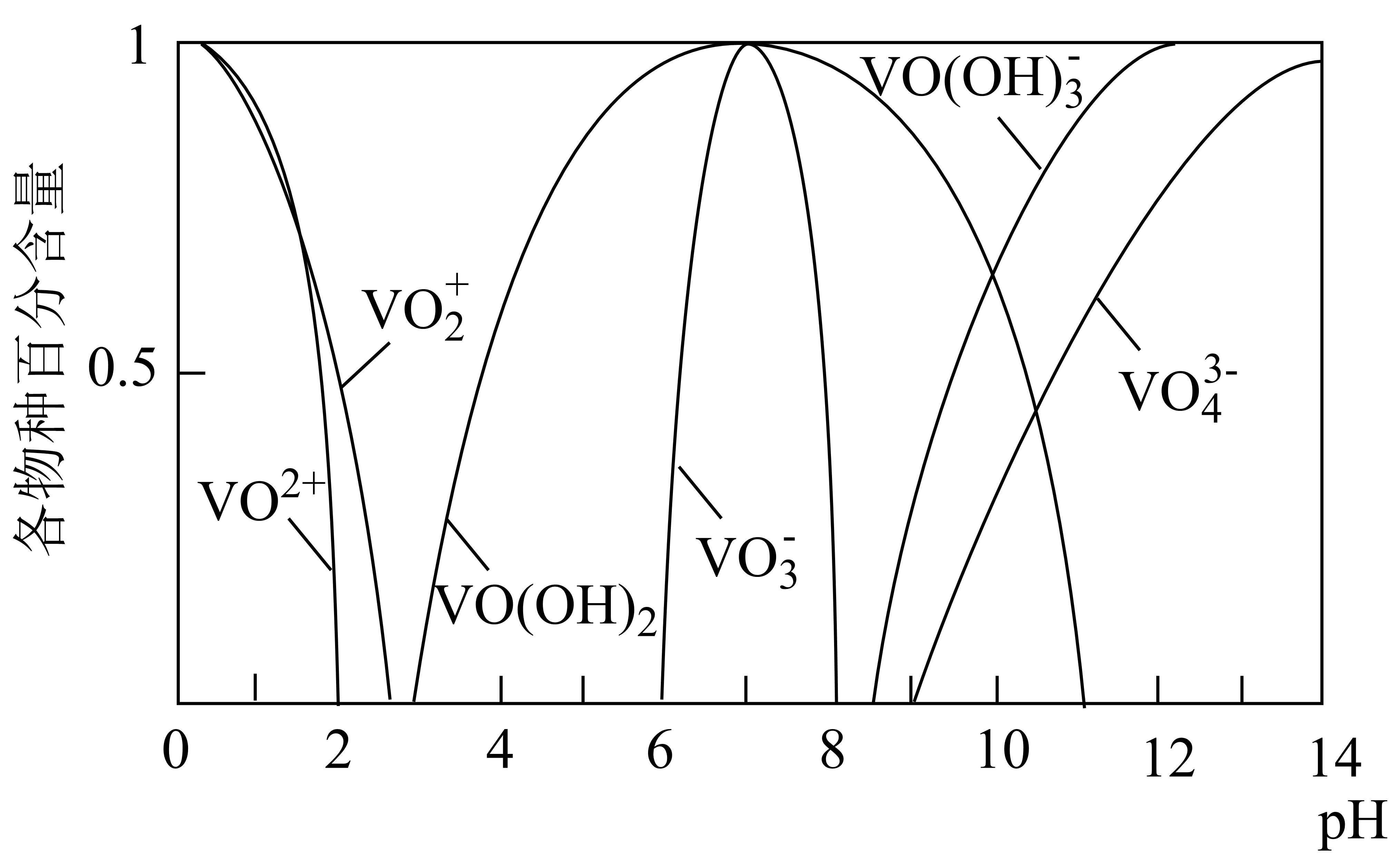
已知:①钒元素的存在形态较多,部分四价钒和五价钒物种的分布分数与pH的关系如图所示。
②Fe(OH)2完全沉淀的pH为8.4;VO(OH)2完全溶解的pH约为11。
③吉布斯自由能(∆G)可以用来判断反应进行的方向。一个反应的∆G越小,反应发生的可能性越大。
-
(1) 写出基态V原子的核外电子排布式。
-
(2) “沉铁”时调节pH时不能用氨水代替氢氧化钠的原因是。
-
(3) 写出“氧化'‘时发生的离子方程式。
-
(4) ①“沉钒沉铝”中所得沉淀物与浸出剂反应∆G与温度的关系如图所示。“浸出”时应控制温度低于60℃,原因是。
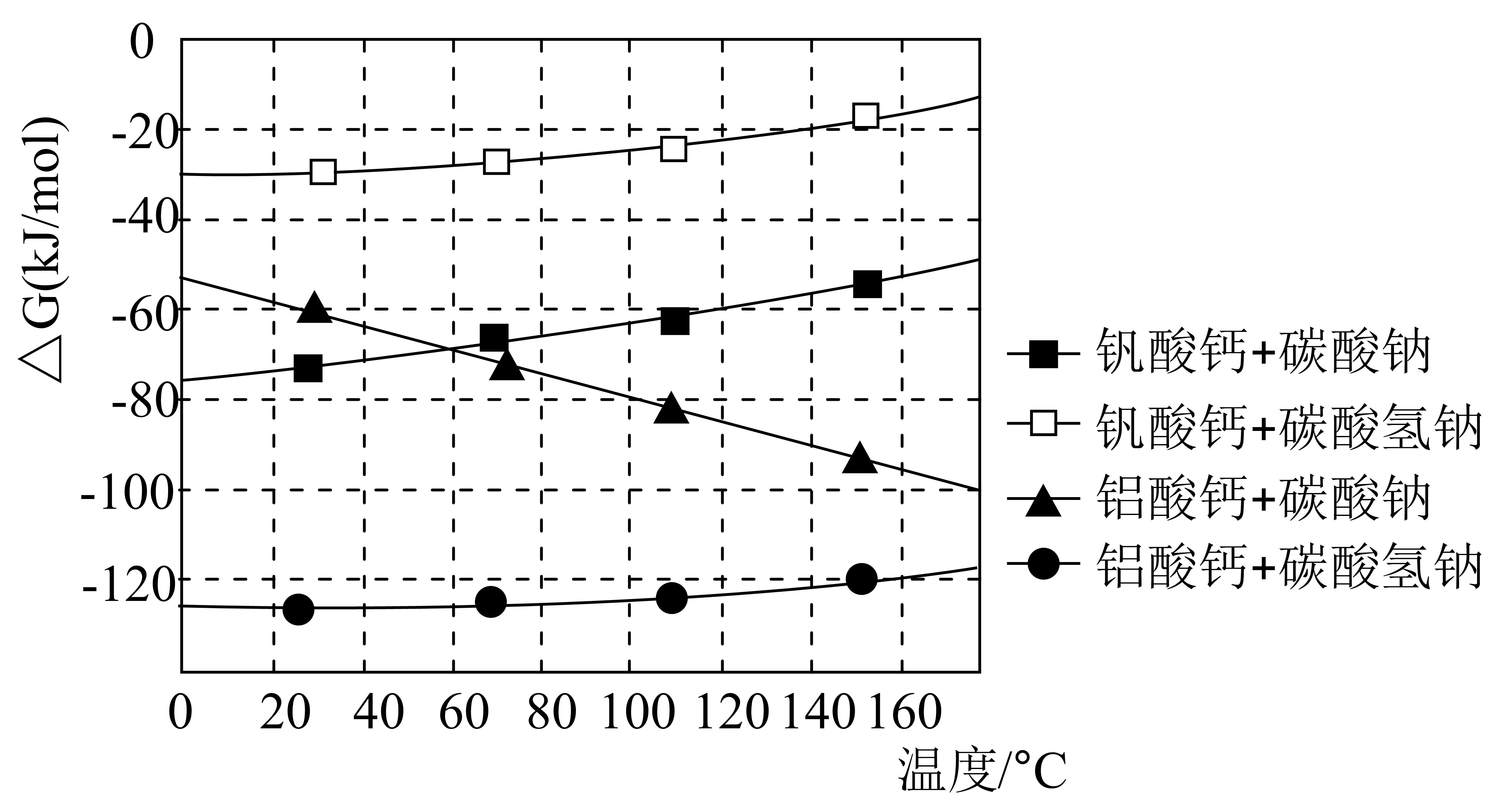
②若“浸出”时浸出剂中添加NaOH固体,并边浸出边通入CO2 , 可大大提高钒的浸出率,原因是。
-
(5) “二次沉钒”时,先调节pH约为6〜8,得到含钒铵盐沉淀,写出“焙烧”时该铵盐沉淀发生分解的化学方程式。
-
(1) 氯原子的最外层电子排布式为;除稀有气体外,比较与氯元素相邻的短周期元素的原子半径大小。
-
(2) 电解饱和食盐水制Cl2时,为节约电能,可改进装置。向阴极通入O2 , 此时阴极上主要的电极反应式为。
-
(3) 氧化法制Cl2是在CuCl2的催化作用下,O2氧化HCl。写出该反应的化学方程式,标出电子转移的方向和数目。
-
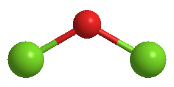
(4) 向饱和氯水中加入适量Ag2O可制HClO溶液,用化学平衡移动原理解释原因。可用Cl2O与水反应来大量生产HClO。Cl2O的球棍模型如图所示,则Cl2O的电子式是,属于分子(选填“极性”或“非极性”)。

-
(1) 检查装置A、B气密性的操作为:先关闭装置A中分液漏斗活塞和装置B中止水夹K,往长颈漏斗中注水至水柱高于广口瓶液面,若观察到,则气密性良好。
-
(2) 装置A中反应的化学方程式为。
-
(3) 实验时,通气一段时间后,C中试管中出现大量淡黄色浑浊现象,证明二氧化硫具有(填“还原性”、“氧化性”或“漂白性”)。
-
(4) 取少量试管D中的溶液,加入BaCl2溶液,产生白色沉淀。
①该白色沉淀为(写化学式)
②原试管D中反应的离子方程式为。
-
(5) 用如图所示装置验证H2SO3酸性比H2CO3强。
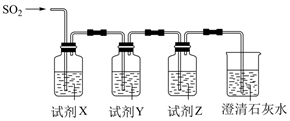
请从下列试剂中选择合适试剂以完成实验(要求:试剂不重复,填代号):
a.品红溶液 b.酸性KMnO4溶液 c.饱和NaHCO3溶液 d.饱和Na2CO3溶液
X为,Y为,Z为。
 , 难溶于水,不溶于乙醇,无味]是重要的化工原料,用途广泛。其制备方法主要是以碘为原料,采用氧化法(氧化剂:
, 难溶于水,不溶于乙醇,无味]是重要的化工原料,用途广泛。其制备方法主要是以碘为原料,采用氧化法(氧化剂: 、
、 、
、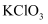 ),先制备
),先制备 , 然后再利用复分解反应制备
, 然后再利用复分解反应制备 。回答下列问题:
。回答下列问题:
-
(1)
 氧化法制备
氧化法制备 。
。
将
 通入含有
通入含有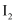 的沸腾蒸馏水中,
的沸腾蒸馏水中,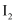 被氧化为
被氧化为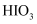 , 再用石灰乳进行中和、分离、洗涤沉淀、干燥,获得
, 再用石灰乳进行中和、分离、洗涤沉淀、干燥,获得 。
。①实验室若利用
 溶液与浓盐酸反应制备一瓶干燥纯净的
溶液与浓盐酸反应制备一瓶干燥纯净的 , 连接顺序为→jh(按气流方向,用小写字母表示)。
, 连接顺序为→jh(按气流方向,用小写字母表示)。
②
 在含
在含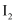 的沸腾蒸馏水中反应生成 物只有两种,写出该反应的化学方程式:;加入石灰乳进行中和时,发生副反应的离子方程式为。
的沸腾蒸馏水中反应生成 物只有两种,写出该反应的化学方程式:;加入石灰乳进行中和时,发生副反应的离子方程式为。 -
(2)
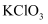 氧化法制备
氧化法制备 。
。
Ⅰ.制备

在如图(夹持仪器和加热装置已省略)所示的三颈烧瓶中加入一定量的I2、
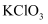 和蒸馏水,再加入盐酸,控制
和蒸馏水,再加入盐酸,控制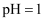 , 反应温度85℃。回流反应1.5小时。
, 反应温度85℃。回流反应1.5小时。
Ⅱ.制备

将Ⅰ所得混合液倒入250
 烧杯中,滴加
烧杯中,滴加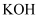 溶液,调节
溶液,调节 , 用滴管逐滴加入1
, 用滴管逐滴加入1 的
的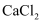 溶液,不断搅拌,至沉淀完全,经冷却、过滤、洗涤、干燥获得
溶液,不断搅拌,至沉淀完全,经冷却、过滤、洗涤、干燥获得 。
。①装置C的作用是吸收反应生成的(填化学式)及挥发出的
 , 以免污染环境。
, 以免污染环境。②实验时,装置A中控制反应温度的方法是。
③步骤Ⅱ洗涤
 的试剂为;若该步骤中pH>10,则可能出现的后果是。
的试剂为;若该步骤中pH>10,则可能出现的后果是。④产品中
 质量分数的测定
质量分数的测定称取1.50g
 产品,加入10
产品,加入10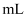 高氯酸溶解,转移到250
高氯酸溶解,转移到250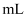 容量瓶中定容。移取25.00
容量瓶中定容。移取25.00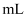 溶液于锥形瓶中,再加入1
溶液于锥形瓶中,再加入1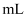 高氯酸,20
高氯酸,20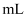 足量
足量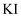 溶液,几滴淀粉溶液作指示剂,用0.10
溶液,几滴淀粉溶液作指示剂,用0.10 的
的 溶液滴定至终点,重复三次,平均消耗45.00
溶液滴定至终点,重复三次,平均消耗45.00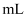
 溶液(已知:
溶液(已知: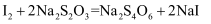 ;高氯酸不参与氧化还原反应)。样品中
;高氯酸不参与氧化还原反应)。样品中 的质量分数为%(保留2位小数)。
的质量分数为%(保留2位小数)。
-
(1) 室温下,含Cr(VI)的微粒在水溶液中存在如下平衡:
H2CrO4⇌H++HCrO
 ΔH1
ΔH1HCrO
 ⇌H++CrO
⇌H++CrO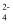 ΔH2
ΔH22HCrO
 ⇌
⇌ +H2O ΔH3
+H2O ΔH3室温下,反应2CrO
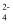 +2H+⇌
+2H+⇌ +H2O的ΔH=(用含ΔH1、ΔH2或ΔH3的代数式表示)。
+H2O的ΔH=(用含ΔH1、ΔH2或ΔH3的代数式表示)。 -
(2) 还原沉淀法:使用Na2SO3将Cr(VI)还原为Cr3+ , 再将Cr3+转化为沉淀除去。
①酸性条件下Cr(VI)具有很强的氧化能力,
 将
将 还原为Cr3+的离子方程式为。
还原为Cr3+的离子方程式为。②其他条件相同,用Na2SO3处理不同初始pH的含Cr(VI)废水相同时间,当pH<2时,Cr(VI)的去除率随pH降低而降低的原因是。
-
(3) 微生物法:
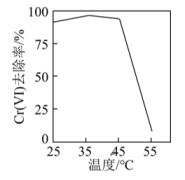
①用硫酸盐还原菌(SRB)处理含Cr(VI)废水时,Cr(VI)去除率随温度的变化如图所示。55℃时,Cr(VI)的去除率很低的原因是。
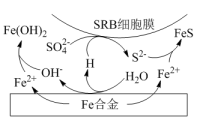
②水体中,Fe合金在SRB存在条件下腐蚀的机理如图所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为Fe2+ , 。
-
(4) 离子交换法:用强碱性离子交换树脂(ROH)与
 和HCrO
和HCrO 等发生离子交换,交换过程中发生如下反应:
等发生离子交换,交换过程中发生如下反应:
ROH(s)+HCrO
 (aq)⇌ RHCrO4(s)+OH-(aq)
(aq)⇌ RHCrO4(s)+OH-(aq)2ROH(s)+
 (aq)⇌ R2CrO4(s)+2OH-(aq)
(aq)⇌ R2CrO4(s)+2OH-(aq)其他条件相同,当pH>4时,Cr(VI)去除率随pH升高而下降的原因是。



