合理利用金属资源 知识点题库
沸腾炉炉度/℃ | 560 | 580 | 600 | 620 | 640 | 660 | |
生成物 | 水溶性Cu% | 90.12 | 91.24 | 93.50 | 92.38 | 89.96 | 84.23 |
酸溶性Cu% | 92.00 | 93.60 | 97.08 | 97.82 | 98.16 | 98.19 | |
酸溶性Fe% | 8.56 | 6.72 | 3.46 | 2.78 | 2.37 | 2.28 |
工业上用的铝上矿(主要成分是氧化铝.含氧化铁杂质)为原料冶炼铝的工艺流程如下:
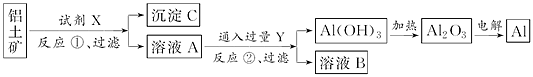
下列叙述正确的是( )
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
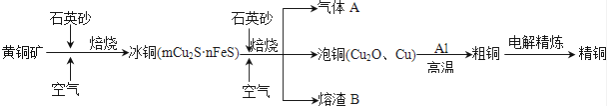
(1)气体A中的大气污染物可选用下列试剂中的 吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),检验溶液中还存在Fe2+的方法是 (注明试剂、现象).
(3)由泡铜冶炼粗铜的化学反应方程式为 .
(4)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4 , 若将该反应设计为原电池,其正极电极反应式为 .
为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:

请回答下列问题:
-
(1) 铁在元素周期表中的位置是 .
-
(2) 写出反应①的化学方程式 ,反应②生成沉淀的离子反应方程式 .
-
(3) 为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选):
.
-
(4) 在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是 .
-
(5) 若考虑绿色化学工艺,在滤渣E中加入稀硫酸和试剂Y制胆矾晶体,试剂Y为无色液体,则反应④的总化学方程式为 ;若不考虑绿色化学工艺,所选试剂Y为1mol/L的硝酸,欲使3molCu全部溶解且溶液中含铜元素的溶质仅为CuSO4 , 则需该硝酸的体积 L.
某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS.某同学用15.0g该废催化剂为原料,回收其中的锌和铜.采用的实验方案如下:

回答下列问题:
-
(1)
在下列装置中,第一次浸出必须用,第二次浸出应选用.(填标号)

-
(2) 第二次浸出时,向盛有滤液1的反应器中加入稀硫酸,后滴入过氧化氢溶液.若顺序相反,会造成.滤渣2的主要成分是.
-
(3) 浓缩硫酸锌、硫酸铜溶液使用的器皿名称是.
-
(4) 某同学在实验完成之后,得到1.5gCuSO4﹒5H2O,则铜的回收率为.
①过滤,出去污泥,
②滤液中加入过量铁粉,,
③过滤,,
④将混有铁粉的Ag用稀硫酸处理,,
⑤过滤,,
⑥将第(3)和(5)步的滤液合并,蒸发浓缩,冷却,,
⑦过滤,得到硫酸亚铁晶体.

已知:ⅰ.试剂价格:漂液(含25.2%NaClO)450元/吨,双氧水(含30%H2O2)2400元/吨.
ⅱ.溶液中离子浓度小于等于1.0×10﹣5mol•L﹣1时,认为该离子沉淀完全.
ⅲ.25℃时,金属离子生成氢氧化物时,开始沉淀和沉淀完全的pH如表所示,
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
Cu(OH)2 | 4.0 | 6.5 |
请回答:
-
(1) 含铜矿石粉碎的目的为,滤渣Ⅰ灼烧所得固体的用途为(任写一种).
-
(2) 操作Ⅰ所用的玻璃仪器为.
-
(3) 试剂1的名称为,选择该试剂的理由为,所发生反应的离子方程式为.
-
(4) 加入试剂2,需调节溶液的pH的合理范围为,试剂2可以选择下列物质中的(填选项字母).
A.Cu B.CuO C.Cu(OH)2 D.Fe
-
(5) 操作3包括蒸发浓缩、、、洗涤、干燥、洗涤的方法为.
-
(6) 25℃时,Cu(OH)2 的溶度积常数K溶[Cu(OH)2]=.

-
(1) 气体A中的大气污染物可选用下列试剂中的吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
-
(2) 用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在(填离子符号),检验溶液中还存在Fe2+的方法是(注明试剂、现象).
-
(3) 由泡铜冶炼粗铜的化学反应方程式为.
-
(4) 利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4 , 若将该反应设计为原电池,其正极电极反应式为.
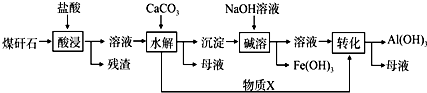
-
(1) “酸浸”过程中主要反应的离子方程式为:、.
-
(2) “酸浸”时,提高浸出速率的具体措施有、.(写出两个)
-
(3) “碱溶”的目的是.物质X的电子式为.该工艺设计中,过量X参与反应的离子方程式是:.
-
(4) 从流程中分离出来的Fe(OH)3沉淀可在碱性条件下用KClO溶液处理,制备新型水处理剂高铁酸钾(K2FeO4),该反应的离子方程式为:.
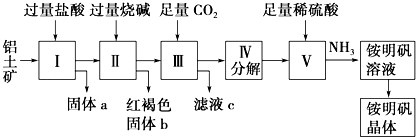
请回答下列问题:
-
(1) 固体a的化学式为,Ⅲ中通入足量CO2气体发生反应的离子方程式为.
-
(2) 由Ⅴ 制取铵明矾溶液的化学方程式为.从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)、冷却结晶、过滤洗涤.
-
(3) 以1000kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3 , 需消耗质量分数98%的硫酸(密度1.84g•cm﹣1)L(计算结果请保留一位小数).
-
(4) 若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量.若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为.
-
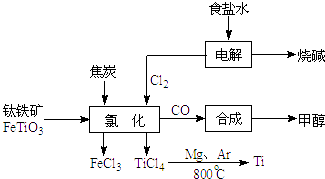
(1) 电解饱和食盐水时,总反应的离子方程式是.
-
(2) 根据上面流程写出钛铁矿经氯化法得到四氯化钛的化学方程式.
-
(3) 已知:①Mg(s)+Cl2(g)=MgCl2(s)△H=﹣641kJ•mol﹣1
②Ti(s)+2Cl2(g)=TiCl4(s)△H=﹣770kJ•mol﹣1则2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s)△H=.反应2Mg(s)+TiCl4(s)
 2MgCl2(s)+Ti,在Ar气氛中进行的理由是:.
2MgCl2(s)+Ti,在Ar气氛中进行的理由是:. -
(4) 以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是
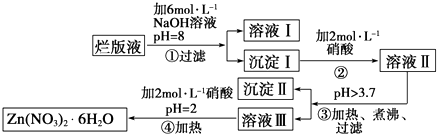
已知:Zn(NO3)2•6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性.
-
(1) “烂版液”中溶质的主要成分是(填化学式,下同).
-
(2) 沉淀Ⅰ的主要成分是.
-
(3) 操作③中加热煮沸的目的是;此步操作的理论依据是.
-
(4) 操作④保持pH=2的目的是.

试回答下列问题:
-
(1) 实验室里过滤用到的玻璃仪器有烧杯、、.
-
(2) 操作Ⅱ中生成不溶物C的离子方程式是.
-
(3) 氧化铝的熔点高达205℃,工业上为降低能耗,在铝的电解冶炼时,采取的措施是.
-
(4) 电解冶炼铝时,阳极和阴极以碳素材料制成,电解过程中,阳极材料需定期进行更换,原因是.
-
(5) 为了提高综合经济效益,实际工业生产中常将上述反应中的相关物质循环利用.其部分转化关系如图所示:
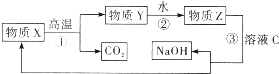
①上述转化中未涉及四种基本反应类型中的反应;
②写出过程③的化学方程式:
-
(6) 科学研究表明,人体过量吸入铝元素会严重危害身体健康.请你结合实际提出两条杜绝铝元素过量吸人的措施:.
![]()
资料:TiCl4及所含杂质氯化物的性质
化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
熔点/℃ | −69 | −25 | 193 | 304 | 714 |
在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 | |
-
(1) 氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:。
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH0(填“>”“<”或“=”),判断依据:。

③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是。
④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有。
-
(2) 精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
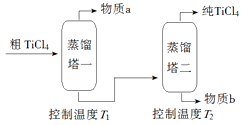
物质a是,T2应控制在。
 不锈钢
B .
不锈钢
B .  硬铝
C .
硬铝
C .  钛合金耐压球壳
钛合金耐压球壳



