合理利用金属资源 知识点题库
部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:下列说法正确的是( )

2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的.因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2).导电乙炔黑(一种炭黑).铝箔以及有机粘接剂.某回收工艺流程如下:

(1)上述工艺回收到的产物有 .
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是 .
(3)碱浸时主要反应的离子方程式为 .
(4)酸浸时反应的化学方程式为 .如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是 .
(5)生成Li2CO3的化学反应方程式为 .已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应 .
某工厂的酸性废水中含有大量的Fe3+、Cu2+、SO42﹣和少量Na+ . 为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾.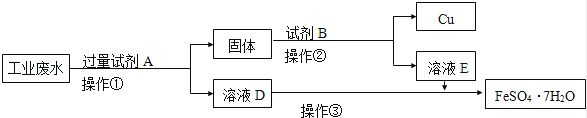
(1)工业废水中加入试剂A后,反应的离子方程式为Fe+Cu2+═Fe2++Cu、Fe+2H+═Fe2++H2↑、 .
(2)试剂B是 .
(3)①~③中均涉及的实验操作是 .
(4)可用绿矾消除工业废水中+6价铬(Cr2O72﹣)的污染,使之转化为Cr3+ , 若处理1t废水(含Cr2O72﹣ 10﹣3 mol/kg),则需加入绿矾的质量至少为 g .
下列说法正确的是( )

-
(1) 酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为.
-
(2) 酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是、.
-
(3) 该厂结合本厂实际,选用的X为(填化学式);中和Ⅰ使溶液中(填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略).
-
(4) 上述流程中洗涤的目的是.
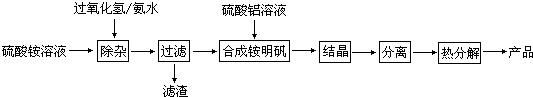
根据上述流程图填空:
-
(1) “除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+ . 请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式.
-
(2) 通常条件下Ksp〔Fe(OH)3〕=4.0×10﹣38 , 除杂后溶液中c(Fe3+)约为.
-
(3) 配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是.
-
(4) “结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水).母液不能蒸干的原因是.
-
(5) “分离”操作的名称是 (填字母代号).A . 蒸馏 B . 分液 C . 过滤
-
(6) 铵明矾晶体的化学式为NH4Al(SO4)2•12H2O,在0.1mol/L铵明矾的水溶液中,离子浓度最大的离子是,离子浓度最小的离子是.
-
(1) Ⅰ污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀.下列物质不能作为沉淀剂的是
A.氨水 B.硫化氢气体
C.硫酸钠溶液 D.纯碱溶液
Ⅱ合成氨的流程示意图如下:
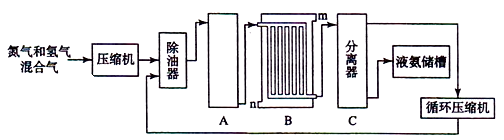
回答下列问题:
工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是,;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式,;
-
(2) 设备A中含有电加热器、触煤和热交换器,设备A的名称,其中发生的化学反应方程式为;
-
(3) 设备B的名称,其中m和n是两个通水口,入水口是(填“m”或“n”).不宜从相反方向通水的原因;
-
(4) 设备C的作用;
-
(5) 在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:
CO(g)+H2O(g)⇌CO2 (g)+H2 (g)
已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于.
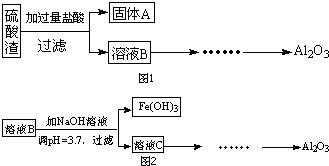
-
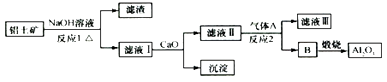
(1) 写出溶液B的溶质是.
-
(2) 参照如图2形式进一步完成“溶液C”到“Al2O3”的流程(注明试剂、条件和操作).
-
(3) 为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成Fe2+ , 再用KMnO4标准溶液在酸性条件下进行氧化还原滴定.写出反应的离方程式:.

已知:Cu2O+2H+=Cu+Cu2++H2O
-
(1) 实验操作I的名称为;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有(填仪器名称).
-
(2) 滤液A中存在的阳离子有,固体混合物B经过提纯后可得SiO2 , 写出它的一种用途
-
(3) 金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程为.
-
(4) 常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH﹣)前者为后者的108倍,则两种溶液的pH=.
-
(5) 从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,涉及的主要步骤为:称取一定质量的样品→→过滤、洗涤、干燥→称量剩余固体铜的质量.(填缺少的操作步骤,不必描述操作过程的细节)
-
(6) 利用电解法进行粗铜精炼时,下列叙述正确的是(填代号).
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.粗铜精炼时通过的电量与阴极析出铜的量无确定关系.

-
(1) 图中标号处需加入的相应物质分别是
①、②、④、⑤.
-
(2) 写出①处发生反应的离子方程式

部分阳离子完全沉淀时溶液的pH如下:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
|
pH |
5.2 |
3.2 |
9.7 |
9.2 |
回答如下问题:
-
(1) 碱浸的目的是为了除去
-
(2) 某学习小组在实验室中模拟上述流程,简述洗涤滤渣①的操作
-
(3) 加入H2O2并保温一段时间过程中,保温的温度不宜过高的原因为,加入H2O2发生反应的离子方程式为。加入H2O2保温后调pH,下列范围合理的是(填选项序号)。
A.1.8~3.2
B.2.0~3.0
C.3.3~5.2
D.9.2~9.7
-
(4) 滤渣③的主要成分为,滤液③调pH为2~3的目的为
-
(5) 为测定产品中NiSO4·7H2O纯度,某同学将一定量的样品溶于水,再向其中加入足量的BaCl2溶液,过滤、洗涤沉淀并干燥,称量质量。通过计算发现产品中NiSO4·7H2O的质量分数大于100%,其可能的原因为

已知:Cr(OH)3是两性氢氧化物,草酸亚铁为微溶物。
回答下列问题:
-
(1) 步骤Ⅰ浸取时,为提高浸取速率,除将高碳铬铁合金制成粉末外,还可采取的措施是(写一点);浸取铬时反应的离子方程式为。
-
(2) 步骤Ⅱ滤渣返回再次浸取的目的是。
-
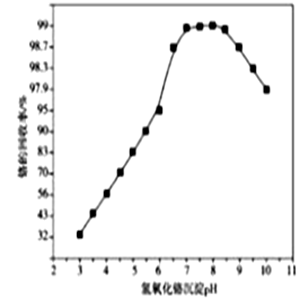
(3) 步骤Ⅲ除铁时,溶液的pH对铁的去除率影响如图所示:

pH小于2.3时,铁去除率低,其原因是。
-
(4) 步骤Ⅳ能说明沉淀已洗涤干净的操作是。
-
(5) 步骤Ⅴ沉铬时,生成Cr(OH)3的化学方程式为;沉铬时,溶液pH与铬的回收率关系如图所示,当pH>8.5时,pH越大,铬的回收率越低,其可能原因是。
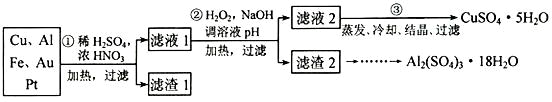
请回答下列问题:
-
(1) 第①步 Cu与酸反应的离子方程式为,得到滤渣 1的主要成分为。
-
(2) 第②步加 H2O2的作用是做氧化剂,将溶液中的 Fe2+氧化为 Fe3+ , 用 H2O2做氧化剂的优点是。
-
(3) 滤渣 2的主要成分是 Al(OH)3和 Fe(OH)3 , 在生产中如何分离两种沉淀,写出反应的离子方程式。
-
(4) 第③步蒸发所需玻璃仪器为。




