合理利用金属资源 知识点题库

填写下面空白。
-
(1) 图中标号处需加入的相应物质分别是①、②、③、④、⑤;
-
(2) 写出①处发生反应的离子方程式;
写出③处发生反应的化学方程式;
-
(3) 铁红的化学式为;分别写出铁红和氧化铜在工业上的一种主要用途:铁红;氧化铜。
某工厂的电镀污泥中含有铜、铁等金属化合物.为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:

沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是 .调pH步骤中加入的试剂最好是 (填化学式).实验室进行过滤操作所用到的玻璃仪器有 .
(2)煮沸CuSO4溶液的原因是 .向CuSO4溶液中加入一定量的NaCl、Na2SO3 , 可以生成白色的CuCl沉淀,写出该反应的化学方程式 .
(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准.称取所制备的CuCl样品0.2500g置于一定量的0.5mol•L﹣1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol•L﹣1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液24.60mL.有关的化学反应为:Fe3++CuCl=Fe2++Cu2++Cl﹣ , Ce4++Fe2+=Fe3++Ce3+ . 通过计算说明该CuCl样品 (填“符合”或“不符合”)国家标准.
(4)25℃时,KSP[Fe(OH)3]=4.0×10﹣38 . Fe3+发生水解反应Fe3++3H2O⇌Fe(OH)3+3H+ , 该反应的平衡常数为 .
地球上的金属矿物资源是有限的,我们必须合理开发和利用这些矿物资源,有效地使用金属产品、材料.主要途径有: , , ; .
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:CuO、Zn、Fe等杂质)为原料获得.操作步骤如下:

-
(1) 加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式
-
(2) 除铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀.加6%的H2O2溶液时,温度不能过高,其原因是: ;在上述方法中,氧化剂可用NaClO3代替,请写出酸性条件下用氯酸钠氧化Fe2+的离子方程式为:
-
(3) 上述流程中滤液Ⅲ的主要溶质的化学式是: 、 .
-
(4) 操作Ⅰ包括以下过程:过滤,用 (填试剂化学式)溶解,蒸发浓缩,冷却结晶,过滤,洗涤获得产品.
皮革工业污泥中含较多的Cr,工业采用以下工艺制得M[Cr(OH)(H2O)5SO4].
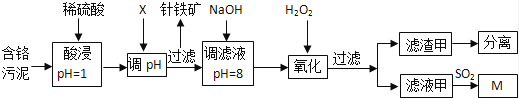
已知:①工艺中硫酸浸取液中的金属离子主要是Cr3+ , 其次是Fe3+、Al3+、Cu2+、Mg2+ .
②常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
|
阳离子 |
Fe3+ |
Al3+ |
Cu2+ |
Mg2+ |
Cr3+ |
|
开始沉淀时的pH |
1.9 |
3.7 |
4.7 |
9.3 |
﹣﹣﹣ |
|
沉淀完全时的pH |
3.2 |
8.0 |
6.7 |
11.1 |
9(>9溶解) |
(1)酸浸时,为了提高浸取效率可采取的措施是 (任写一条).
(2)调节pH所用X可以选用 .
A.NaOH B.Na2CO3 C.H2SO4 D.HNO3
(3)加入H2O2目的是把Cr(OH)3沉淀转化为Cr2O72﹣ , 写出该反应的离子方程式 .针铁矿组成元素是Fe、H、O,化学式量为89,其化学式是 .
(4)调滤液至pH=8,Al3+、Cu2+、Mg2+中的 将转化为沉淀.
(5)若滤液甲的pH=a,则溶液中c (Cu2+)= .(25℃时的Ksp[Cu(OH)2]=2.2×10﹣20)
-
(1) 工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:

①沸腾氯化炉中发生的主要反应为:.
②已知:Ti(s)+2Cl2(g)=TiCl4(l)△H=a kJ•mol﹣1;2Na(s)+Cl2(g)=2NaCl(s)△H=b kJ•mol﹣1;Na(s)=Na(l)△H=c kJ•mol﹣1;则:TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s)△H=kJ•mol﹣1 .
-
(2) TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如图所示,二氧化钛电极连接电源极,该极电极反应为:.但此法会产生有毒气体,为减少对环境的污染,在电池中加入固体氧离子隔膜(氧离子能顺利通过),将两极产物隔开,再将石墨改为金属陶瓷电极,并通入一种无毒的还原性气体,该气体是.

-
(3) 海绵钛可用碘提纯,原理为:,下列说法正确的是 .A . 该反应正反应的△H>0 B . 在不同温度区域,TiI4的量保持不变 C . 在提纯过程中,I2的作用是将粗钛从低温区转移到高温区 D . 在提纯过程中,I2可循环利用.

-
(1) 在实验中需用1mol•L﹣1的NaOH溶液480mL,配制该溶液已有下列仪器:托盘天平(砝码)、胶头滴管、药匙、玻璃棒,还缺少的仪器.在灼烧操作中用到下列仪器中的一种,其名称是

-
(2) 写出步骤①中发生反应的离子方程式.
-
(3) 操作③中的洗涤操作如何进行?
-
(4) 甲同学在实验室中用如图装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象.
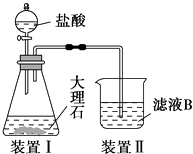
乙同学分析认为:甲同学通入CO2的量不足是导致实验失败的原因之一,你认为乙的分析是否合理?.若合理,请用离子方程式解释其原因 (若你认为不合理,该空不作答).
丙同学分析认为:甲同学通入的CO2中含有HCl气体,也是导致实验失败的原因,在实验中增加某装置可解决这个问题.请帮助丙同学画出该装置图,并注明试剂名称.

-
(1) A的化学式为,E的化学式为.
-
(2) B的化学成分,回收的铜是(填A、B、C、D或E).
-
(3) 根据图示,反应②的化学方程式为.

请回答:
-
(1) 绿矾的化学式为.
-
(2) 写出反应①的化学方程式,反应②生成沉淀的离子反应方程式.
-
(3) 为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选):.
-
(4) 在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是.
-
(5) 若考虑绿色化学工艺,在滤渣E中加入稀硫酸和试剂Y制胆矾晶体,试剂Y为无色液体,则反应④的总化学方程式为;若不考虑绿色化学工艺,所选试剂Y为1mol/L的硝酸,欲使3molCu全部溶解且溶液中含铜元素的溶质仅为CuSO4 , 则需该硝酸的体积L.
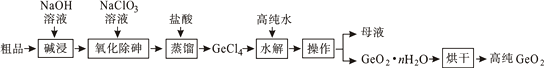
已知:①“碱浸”过程中的反应为:GeO2+2NaOH=Na2GeO3+H2O、As2O3+2NaOH=2NaAsO2+H2O
② GeCl4的熔点为-49.5℃,AsCl3与GeCl4的沸点分别为130.2℃、84℃。
-
(1) 砷的原子序数为33,砷在元素周期表中的位置为第周期第族。
-
(2) “氧化除砷”的过程是将NaAsO2氧化为Na3AsO4 , 其反应的离子方程式为: 。
-
(3) 传统的提纯方法是将粗品直接加入盐酸中蒸馏,其缺点是。
-
(4) “蒸馏”过程中的反应的化学方程式为:。
-
(5) “水解”操作时保持较低温度有利于提高产率,其最可能的原因是(答一条即可)。
-
(6) 若1吨二氧化锗粗品(含杂质30%)经提纯得0.745吨的较纯二氧化锗产品,则杂质脱除率为。
-
(7) 和砷同一主族的锑也可以用于半导体中。一种突破传统电池设计理念的镁—锑液态金属二次电池工作原理如图所示:

该电池由于密度的不同,在重力作用下分为三层,工作时中间层熔融盐的组成不变。充电时,Cl-向(填“上”或“下”)移动;放电时,正极的电极反应式为。

回答下列问题
-
(1) “浸取”实验中,反应体系的温度、反应时间对锰脱除效果的影响如下表,则适合的温度和反应时间分别是、。
表1 温度对锰脱除效果的影响
温度/℃
ρ(Mn2+)/mg·L-1
除锰率/%
10
0.325
87.9
30
0.341
89.5
50
0.424
84.3
70
0.646
76.1
表2 反应时间对锰脱除效果的影响
时间/h
ρ(Mn2+)/mg·L-1
除锰率/%
1.0
0.995
63.1
1.5
0.794
70.6
2.0
0.328
87.9
2.5
0.325
87.9
-
(2) “滤渣1”的主要成分是。
-
(3) H2O2溶液的作用是,已知“滤渣2”的主要成分是Fe(OH)3 , 则氧化锌的作用是。“置换”实验中发生的反应的离子方程式有Zn+Pb2+=Ph+Zn2+、。
-
(4) 由锌灰制取金属锌可采用碱溶解,然后电解浸取液,已知:ZnO溶于NaOH溶液中生成[Zn(OH)4]2- , 则阴极的电极反应为。
-
(5) ZnCl2晶体溶解于饱和Na2CO3溶液中,得到6.46g的碱式碳酸锌[Znx(CO3)y(OH)z , 为了测定其组成,充分加热分解,产生的气体依次通入浓硫酸和碱石灰,质量分别增重了0.72g和0.88g,则该碱式碳酸锌的化学式为。

-
(1) 试剂X为,试剂Y为 。
-
(2) 反应②的离子反应方程式为。
-
(3) 检验滤液C中是否含有Fe3+的操作为。
-
(4) 操作III的名称为,该操作所用的玻璃仪器为。
-
(5) 实验室保存FeSO4溶液时常加入铁粉,加入铁粉的作用是。
-
(1) 金属冶炼的实质是金属离子被(填“氧化”或“还原”)生成金属单质。
-
(2) 铜在自然界存在于多种矿石中,如:
矿石名称
黄铜矿
辉铜矿
孔雀石
主要成分
CuFeS2
Cu2S
Cu2(OH)2 CO3
请回答下列问题:
① 上表所列铜化合物中,推断铜的质量百分含量最高的是。
② CuFeS2其中 Cu 为+1 价、Fe 为+3 价,高温焙烧时发生的反应是CuFeS2 + O2
 SO2 +FeS +Cu,焙烧过程中被还原的元素有。
SO2 +FeS +Cu,焙烧过程中被还原的元素有。③ 工业上以黄铜矿为原料,采用火法熔炼工艺生产铜,火法炼铜的反应为:Cu2S+O2
 2Cu+SO2 , 该反应中氧化剂是。
2Cu+SO2 , 该反应中氧化剂是。④ Cu2(OH)2 CO3 与稀硫酸反应的离子方程式为。
A | B | C | D |
|
|
|
|
用生铁铸造的下水井盖 | 用不锈钢制造的地铁列车车体 | 用硬铝制造的飞机外壳 | 用储氢合金装配的以H2为燃料的汽车 |







