铁的化学性质 知识点
铁的化学性质:铁是比较活泼的金属,在金属活动顺序表里排在氢的前面。常温时,铁在干燥的空气里不易与氧、硫、氯等非金属单质起反应,在高温时,则剧烈反应。铁在氧气中燃烧,生成Fe3O4,炽热的铁和水蒸气起反应也生成Fe3O4。铁易溶于稀的无机酸和浓盐酸反应,生成二价铁盐,并放出氢气。在常温下遇浓硫酸或浓硝酸时,表面生成一层氧化物保护膜,使铁“钝化”,故可用铁制品盛装浓硫酸或浓硝酸。铁是一变价元素,常见价态为+2和+3。铁与硫、硫酸铜溶液、盐酸、稀硫酸等反应时失去两个电子,成为+2价。与Cl2、Br2、硝酸及热浓硫酸反应,则被氧化成Fe3+。铁与氧气或水蒸气反应生成的Fe3O4,可以看成是FeO·Fe2O3,其中有1/3的Fe为+2价,另2/3为+3价。铁的+3价化合物较为稳定。
铁的化学性质 知识点题库
下列有关物质的性质或应用的说法中正确的是( )
A . 铝合金是一种混合物,它比纯铝的熔点高
B . 高炉中的主要反应是高温下焦炭和氧化铁直接作用炼出生铁
C . 铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面形成了一层致密稳定的氧化膜
D . 电解从海水中得到的氯化镁溶液可获得金属镁
下列叙述中正确的是( )
A . 将高温水蒸气通过炽热的铁粉,铁粉变红色
B . 向Fe(OH)3胶体中滴加稀H2SO4 , 先出现沉淀,后沉淀溶解
C . 向FeCl2溶液中加入几滴KSCN溶液,溶液变为血红色,则FeCl2溶液完全变质
D . 铝在空气中耐腐蚀,所以铝是不活泼金属
下列有关实验现象的描述正确的是( )
A . 铁丝在空气中被点燃,火星四射
B . 氧化铁放入氢氧化钠溶液中,生成红褐色沉淀
C . 点燃氢气和一氧化碳的混合气体,发生猛烈爆炸
D . 氯化铜溶液中滴入氢氧化钠溶液,产生蓝色沉淀
铁及其化合物是一类重要的物质,在人类的生产和生活中具有广泛的用途.
-
(1) 能用来制作红色涂料的铁的氧化物是(填化学式).
-
(2) 向一定浓度的FeCl2溶液中滴加一定体积的30%的双氧水,可以观察到溶液变为红褐色,且能发生丁达尔效应,用pH计测得溶液pH变小.写出FeCl2与H2O2反应的离子方程式:.
-
(3) 如图为一电化学装置,电极分别为铁棒和碳棒.U形管中盛有饱和电解质溶液.

①若U形管中盛食盐水饱和溶液,打开K2 , 闭合K1 , 铁棒为极,铁棒腐蚀速率(填“变快”“变慢”或“不变”),碳棒上的电极反应式为.
②若U形管中盛有NaOH浓溶液,打开K1 , 闭合K2 . 可以制备新型净水剂高铁酸盐(FeO42﹣).阳极电极反应式为,阴极区溶液的pH (填”增大”‘减小”或“不变”).
下列实验操作对应的实验现象及解释或结论都正确的是( )
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 用某无色溶液进行焰色反应 | 透过钴玻璃,火焰呈紫色 | 原溶液一定是钾盐溶液 |
B | 向NaOH溶液中滴加足量的MgCl2溶液,然后再滴加足量的CuCl2溶液 | 先产生白色沉淀,然后沉淀变成蓝色 | Ksp[Cu(OH)2]sp[Mg(OH)2] |
C | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水蒸气在高温下发生反应 |
D | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
A . A
B . B
C . C
D . D
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A . Fe  FeCl2
FeCl2  Fe(OH)2
B . S
Fe(OH)2
B . S  SO3
SO3  H2SO4
C . CaCO3
H2SO4
C . CaCO3  CaO
CaO  CaSiO3
D . NH3
CaSiO3
D . NH3  NO
NO  HNO3
HNO3
 FeCl2
FeCl2  Fe(OH)2
B . S
Fe(OH)2
B . S  SO3
SO3  H2SO4
C . CaCO3
H2SO4
C . CaCO3  CaO
CaO  CaSiO3
D . NH3
CaSiO3
D . NH3  NO
NO  HNO3
HNO3
下列有关元素及其化台物的说法正确的是( )
A . 水蒸气通过灼热的铁粉生成四氧化三铁和氢气
B . FeCl3既能通过化台反应制得,也能通过金属与酸的置换反应制得
C . Na在空气中长期放置最终变为Na2CO3粉末
D . 向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀
铁在一定条件下与纯O2、水蒸气反应的共同产物是( )
A . FeO
B . Fe2O3
C . Fe3O4
D . Fe(OH)2
实验室制备莫尔盐[(NH4)2SO4 . FeSO4·6H2O]的过程是:向稀H2SO4中加入过量的铁屑,充分反应后过滤,向滤液中加入一定量的(NH4)2SO4饱和溶液。经蒸发浓缩、冷却结晶、过滤,得到莫尔盐晶体。下列说法正确的是( )
A . 铁屑上若有少量铁锈,将导致莫尔盐中混入杂质Fe2(SO4)3
B . 蒸发浓缩使用的仪器有坩埚、玻璃棒、酒精灯
C . 室温时,莫尔盐的溶解度比(NH4)2SO4和FeSO4的都小
D . 晶体析出后,取少量母液加入K3[Fe(CN)6],无蓝色沉淀生成
化工产品在下列应用中,表现出还原性的是( )
A . 明矾作净水剂
B . 漂粉精作消毒剂
C . 铁粉作食品脱氧剂
D . 浓硫酸作干燥剂
国家标准规定,室内甲醛含量不能超过0.08 mg/m3。银一菲洛嗪法可用于测定空气中甲醛含量,其原理为:①Ag2O将甲醛氧化为CO2;②产生的Ag与酸化的Fe2(SO4)3溶液反应生成FeSO4;③FeSO4与菲洛嗪(一种有机钠盐)形成有色配合物,一定波长下其吸光度与Fe2+的质量浓度成正比。下列关于a~c的判断正确的是( )
a.反应①的化学方程式为HCHO+2Ag2O=CO2↑+ 4Ag↓+H2O
b.理论上吸收的HCHO与消耗的Fe3+的物质的量比为1:4
c.取1m3空气,经上述实验后共得到Fe2+ 1.12 mg,室内甲醛含量达标
A . a正确,b、c错误
B . a、b正确,c错误
C . b、c正确,a错误
D . 全部正确
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是( )
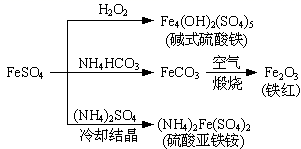
A . 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B . 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C . 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D . 常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
下列物质间的转化不能通过一步反应实现的是( )
A . Na2CO3→NaOH
B . Fe→FeCl2
C . Fe(OH)2→Fe(OH)3
D . SiO2→H2SiO3
下列实验现象叙述正确的是( )
A . 滴入硝酸酸化的BaCl2 溶液,产生白色沉淀,溶液中一定存在SO42-
B . 硫粉在纯氧中燃烧:产生明亮的蓝紫色火焰,放热,生成有刺激性气味的气体
C . 铁粉加入稀硫酸,银白色固体表面有气泡产生,固体减少,放热,溶液由无色变浅绿色
D . 水通电:两极均有气体生成,正极多,负极少,体积比约为1:2
铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只和NO):
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.0 | 9.6 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
下列计算结果错误的是( )
A . ①中溶解了8.4gFe
B . 原混合物总质量为105.6g
C . 硝酸的浓度为4mol/L
D . ④中V=6720
下列物质反应后一定有+3价铁生成的是( )
①过量的Fe在Cl2中燃烧;②Fe和过量盐酸反应;③向FeCl2溶液中通入少量Cl2;④将Fe和Fe2O3的混合物溶于盐酸中
A . ①
B . ①③
C . ①②③
D . ①②③④
下列说法中正确的是( )
A . 铝在空气中或纯氧中燃烧,主要产物都是Al2O3
B . 钠在空气中缓慢氧化或在空气中燃烧,产物都是Na2O2
C . 铁片在常温下与稀硫酸或浓硫酸反应,都生成FeSO4
D . 镁在空气中或纯氧中燃烧,产物都只有MgO
将5.6g铁粉加到50mL2mol•L-1FeCl3溶液中,完全反应后(假设溶液的体积不变),下列结论错误的是( )
A . 溶液中n(Fe2+)为0.3mol
B . 向溶液中滴加无色KSCN溶液,不变色
C . 铁有剩余,溶液呈浅绿色,c(Cl-)基本不变
D . 氧化产物与还原产物的物质的量之比为1:2
铁及其化合物的相互转化关系如框图,其中②的焰色反应呈黄色,请回答相关问题。
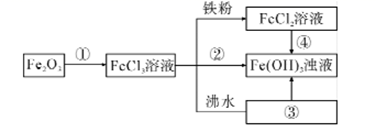
-
(1) 图中①②③代表的分散系分别是(用化学式及必要文字填写):
①;②;③
-
(2) 写出框图中涉及到的氧化还原反应的离子反应方程式(只写一个即可),并用单线桥标出电子转移的方向和数目。
-
(3) 写出将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③的化学方程式。在分散系③中插入两个惰性电极,接通直流电源,会发现极附近颜色变深,这个现象称为。向分散系③中逐滴滴入分散系①至过量,整个过程的现象是。
-
(4) 16.8gFe在纯氧中完全燃烧转移的电子数为。
类推思想在化学学习与研究中经常被采用,但类推出的结论是否符合题意最终要经过实验的验证。以下类推的结论中正确的是:( )
A . SO2能使酸性KMnO4溶液褪色,故CO2也能使酸性KMnO4溶液褪色
B . 盐酸与镁反应生成氢气,故硝酸与镁反应也生成氢气
C . 铁与Cl2反应生成FeCl3 , 故铁与I2反应生成FeI3
D . 常温下浓硫酸能使铁和铝钝化,故常温下浓硝酸也能使铁和铝钝化
最近更新



