铁的化学性质 知识点题库
将1.12g铁粉加入25mL 2mol/L的FeCl3溶液中,充分反应后,其结果是( )
A . 铁粉有剩余,溶液呈浅绿色,Cl﹣基本保持不变
B . 往溶液中滴入无色KSCN溶液,不显红色
C . Fe2+和Fe3+物质的量之比为6:1
D . 氧化产物和还原产物的物质的量之比为2:5
下列关于铁的叙述正确的是( )
①铁能被磁铁吸引,但纯铁易腐蚀
②在人体的血红蛋白中含有铁元素
③铁位于元素周期表中第四周期第ⅧB族
④铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧
⑤铁与强氧化剂硝酸反应的产物仅是Fe(NO3)3
⑥不能通过化合反应制得FeCl2和Fe(OH)3 .
A . ①③
B . ②④
C . ②⑤
D . ④⑥
下列说法正确的是( )
A . Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
B . 常温下,铜片放入浓硫酸中,无明显变化,说明铜在冷的浓硫酸中发生钝化
C . Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
D . 分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水
下列说法正确的是( )
A . 水蒸气通过炽热的铁,生成Fe2O3和H2
B . 用湿润的淀粉碘化钾试纸检验某气体,试纸变蓝,该气体一定是Cl2
C . 除去NO中混有的少量NO2 , 可将混合气体通过盛有水的洗气瓶,再用排空气法收集NO
D . 反应MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中,每析出12.8 g S共转移0.8mol
将铁粉、铜粉、FeCl3溶液和CuCl2溶液混合于某容器中充分反应(假定容器不参与反应).试判断下列情况下,溶液中存在的金属离子和金属单质.
-
(1) 若铁粉有剩余,则容器中不可能有的离子是,铜单质(填“一定”或“可能”)存在.
-
(2) 若CuCl2有剩余,则容器中还可能有的离子为,铜单质(填“一定”或“可能”)存在.
-
(3) 若FeCl3和CuCl2都有剩余,则容器中不可能有的单质是,Fe2+(填“一定”或“可能”)存在.
把铁片分别放入下列溶液中,铁片溶解,而溶液质量增加,但无气体产生,此溶液是( )
A . 稀硫酸
B . AgNO3溶液
C . Fe2(SO4)3溶液
D . CuSO4溶液
为了探究铁、铜及其化合物的性质,某同学设计并进行了下列两组实验。
-
(1) 实验一:

已知:3Fe(s)+4H2O(g)
 Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)虚线框处宜选择的装置是(填“甲”或“乙”);实验时应先将螺旋状铜丝加热,变黑后再趁热迅速伸入所制得的纯净氢气中,观察到的实验现象是。
-
(2) 实验后,为检验硬质玻璃管中的固体是否含+3价的铁元素,该同学取一定量的固体并用一定浓度的盐酸溶解,滴加溶液(填试剂名称或化学式),没有出现血红色,说明该固体中没有+3价的铁元素。请你判断该同学的结论是否正确并说明理由。
-
(3) 实验二:
绿矾是含有一定量结晶水的硫酸亚铁,为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A 称重,记为m2 g,B为干燥管。按下图连接好装置进行实验。
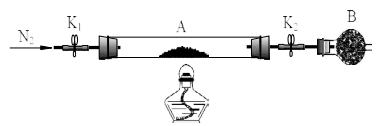
实验步骤如下:①,②点燃酒精灯,加热,③,④,⑤,
⑥称量A, 重复上述操作步骤,直至 A 恒重,记为m3 g。
请将下列实验步骤的编号填写在对应步骤的横线上
a.关闭 K1 和 K2
b.熄灭酒精灯
c.打开 K1 和 K2 缓缓通入 N2
d.冷却至室温
-
(4) 必须要进行恒重操作的原因是。
-
(5) 已知在上述实验条件下,绿矾受热只是失去结晶水,硫酸亚铁本身不会分解, 根据实验记录,计算绿矾化学式中结晶水数目 x=(用含 m1、 m2、 m3的列式表示)。
下列关于金属的说法正确的是( )
A . 铝箔在空气中受热可以熔化且会发生剧烈燃烧
B .  在空气中燃烧,发出黄色火焰,生成白色固体
C . 铁与水蒸气反应的产物是黑色的
在空气中燃烧,发出黄色火焰,生成白色固体
C . 铁与水蒸气反应的产物是黑色的  D . 铝制餐具不宜用来盛装酸性、碱性较强的食物
D . 铝制餐具不宜用来盛装酸性、碱性较强的食物
 在空气中燃烧,发出黄色火焰,生成白色固体
C . 铁与水蒸气反应的产物是黑色的
在空气中燃烧,发出黄色火焰,生成白色固体
C . 铁与水蒸气反应的产物是黑色的  D . 铝制餐具不宜用来盛装酸性、碱性较强的食物
D . 铝制餐具不宜用来盛装酸性、碱性较强的食物
下列推断正确的是( )
A . 铝粉在氧气中燃烧生成Al2O3 , 故铁丝在氧气中燃烧生成Fe2O3
B . 铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜
C . 钠与氧气、水等反应时钠均作还原剂,故金属单质参与化学反应时金属均作还原剂
D . 活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A . SO2  CaSO3
CaSO3  CaSO4
B . Fe
CaSO4
B . Fe  Fe2O3
Fe2O3  FeCl3
C . HCl(aq)
FeCl3
C . HCl(aq)  Cl2
Cl2  Ca(ClO)2
D . Cu2(OH)2CO3
Ca(ClO)2
D . Cu2(OH)2CO3  CuO
CuO  CuCl2(aq)
CuCl2(aq)
 CaSO3
CaSO3  CaSO4
B . Fe
CaSO4
B . Fe  Fe2O3
Fe2O3  FeCl3
C . HCl(aq)
FeCl3
C . HCl(aq)  Cl2
Cl2  Ca(ClO)2
D . Cu2(OH)2CO3
Ca(ClO)2
D . Cu2(OH)2CO3  CuO
CuO  CuCl2(aq)
CuCl2(aq)
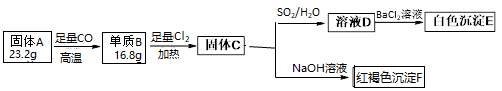
为探究某固体氧化物A(仅含两种元素)的组成和性质,设计并完成如下实验。请回答:
-
(1) 固体A的化学式。
-
(2) 单质B在氯气中反应的现象。
-
(3) 写出C→D在溶液中发生氧化还原反应的离子方程式。
为了探究铁与氯气的反应,某同学设计了如下实验装置。(部分夹持仪器已略去)
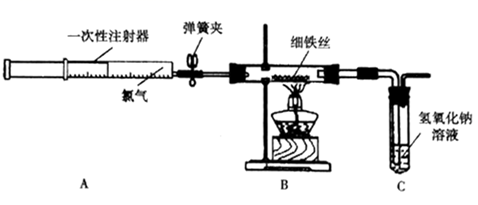
-
(1) 实验开始前需进行的一项操作是。
-
(2) 加热玻璃管中的铁丝约1min,打开弹簧夹,推动注射器的活塞注入一定量氯气,玻璃管内的现象是,有关反应的化学方程式是。
-
(3) 用氯气将玻璃管内的少量生成物吹入氢氧化钠溶液中,预测试管中可能产生的现象是。连接B与C的导管较粗,其目的是。
表示下列指定反应的化学方程式正确的是( )
A . 用赤铁矿炼铁:Fe2O3+3CO  2Fe+3CO2
B . 铁与稀盐酸反应:2Fe+6HCl=2FeCl3+3H2↑
C . 电解饱和食盐水:2NaCl+2H2O
2Fe+3CO2
B . 铁与稀盐酸反应:2Fe+6HCl=2FeCl3+3H2↑
C . 电解饱和食盐水:2NaCl+2H2O  2NaOH+Cl2↑
D . 实验室制氧气:H2O2
2NaOH+Cl2↑
D . 实验室制氧气:H2O2  H2↑+O2↑
H2↑+O2↑
 2Fe+3CO2
B . 铁与稀盐酸反应:2Fe+6HCl=2FeCl3+3H2↑
C . 电解饱和食盐水:2NaCl+2H2O
2Fe+3CO2
B . 铁与稀盐酸反应:2Fe+6HCl=2FeCl3+3H2↑
C . 电解饱和食盐水:2NaCl+2H2O  2NaOH+Cl2↑
D . 实验室制氧气:H2O2
2NaOH+Cl2↑
D . 实验室制氧气:H2O2  H2↑+O2↑
H2↑+O2↑
下列转化不能通过一步反应实现的是( )
A . 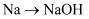 B .
B .  C .
C .  D .
D . 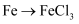
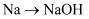 B .
B .  C .
C .  D .
D . 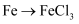
下列有关反应的离子方程式书写正确的是( )
A . 氯气溶于水: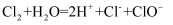 B . Fe溶于足量稀
B . Fe溶于足量稀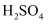 :
: C . 向
C . 向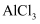 溶液中加入过量浓氨水:
溶液中加入过量浓氨水: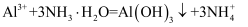 D . 将铝粉与NaOH溶液混合:
D . 将铝粉与NaOH溶液混合: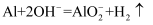
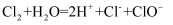 B . Fe溶于足量稀
B . Fe溶于足量稀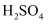 :
: C . 向
C . 向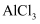 溶液中加入过量浓氨水:
溶液中加入过量浓氨水: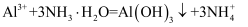 D . 将铝粉与NaOH溶液混合:
D . 将铝粉与NaOH溶液混合: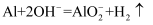
下列试剂的贮存方法或解释不正确的是( )
A . 金属Na保存在煤油中,防止与空气中的O2和H2O反应
B . 新制氯水保存在棕色瓶中并置于冷暗处,防止次氯酸的分解
C . FeSO4溶液中放有少量铁粉,防止其被氧化
D . 漂白粉应密封保存,防止被空气中的氧气氧化
化学与生产、生活、科技息息相关,下列说法正确的是( )
A . 利用微生物降解水域中的有毒有害物质涉及到化学反应
B . 硅单质常被用于制造太阳能电地和制作光导纤维
C . 常温下,铁不与浓硝酸反应,所以可用铁质容器储运冷的浓硝酸
D . “84”消毒液和75%酒精杀灭COVID-19时均表现为强氧化性
铁与下列足量溶液发生反应,一定有固体剩余的是( )
A . 稀硫酸
B . 稀硝酸
C . 热的浓硫酸
D . 冷的浓硝酸
在题给条件下,下列选项所示的物质间转化能实现的是( )
A .  B . C6H12O6(葡萄糖,aq)
B . C6H12O6(葡萄糖,aq)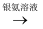 Ag(s)
C .
Ag(s)
C .  D .
D . 

 B . C6H12O6(葡萄糖,aq)
B . C6H12O6(葡萄糖,aq)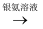 Ag(s)
C .
Ag(s)
C .  D .
D . 

在给定的条件下,下列选项所示的物质间转化均能实现的是( )
A . 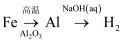 B .
B .  C .
C .  D .
D . 
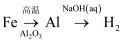 B .
B .  C .
C .  D .
D . 
最近更新



