铁的化学性质 知识点题库
下列有关物质的性质或应用均正确的是( )
A . Si是一种非金属主族元素,其氧化物可用于制作计算机芯片
B . 氢氧化镁分解时吸收大量的热量,添加到合成树脂中可作阻燃剂
C . 铁具有良好的导电性,氯碱工业中可用铁作阳极电解食盐水
D . 用二氧化硫加工银耳,使之更白
下列化合物中,不能通过单质间化合直接制取的是( )
A . FeCl2
B . CuCl2
C . HCl
D . FeCl3
常温下能用铁制容器盛放的是( )
A . 浓硫酸
B . 浓盐酸
C . 硫酸铜
D . 稀硫酸
下列关于铁及其化合物的说法正确的是( )
A . 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红,可以检验Fe(NO3)2晶体是否已氧化变质
B . 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
C . 1 mol FeI2与足量氯气反应时转移的电子数为2NA
D . 水溶液中Fe2+、H+、SO  、ClO﹣不能大量共存
、ClO﹣不能大量共存
 、ClO﹣不能大量共存
、ClO﹣不能大量共存
下列氯化物中,既能由金属和氯气直接反应得到,又能由金属和盐酸反应制得的是( )
A . FeCl2
B . AlCl3
C . FeCl3
D . CuCl2
下列有关元素及其化合物的说法正确的是( )
A . 水蒸气通过灼热的铁粉生成氢氧化铁和氢气
B . FeCl3 既能通过化合反应制得,也能通过金属与酸的置换反应制得
C . Na 在空气中长期放置最终变为 Na2CO3 粉末
D . 向 KClO3 溶液中滴加 AgNO3 溶液得到白色 AgCl 沉淀
某100mL的溶液中仅含有以下三种溶质:
| 溶质 | H2SO4 | HNO3 | KNO3 |
| 浓度(mol/L) | 6 | 2 | 1 |
向该溶液中加入过量的铁粉,最多可产生标准状况下的气体体积为( )
A . 8.96L
B . 6.72L
C . 4.48L
D . 2.24L
把22.4g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.3 mol NO2和0.2 mol NO,下列说法正确的是( )
A . 反应后生成的盐只为Fe(NO3)3
B . 反应后生成的盐只为Fe(NO3)2
C . 反应后生成的盐为Fe(NO3)3和Fe(NO3)2 , 其物质的量之比为1∶3
D . 反应后生成的盐为Fe(NO3)3和Fe(NO3)2 , 其物质的量之比为3∶1
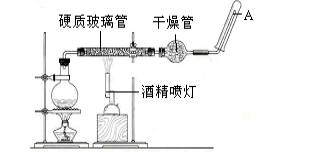
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。
-
(1) 写出该反应的反应方程式:;并指明该氧化还原反应的还原剂是 ,氧化剂是。
-
(2) 圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶底部放置了几片碎瓷片,其作用是 。
-
(3) 酒精灯和酒精喷灯点燃的顺序是 ,为什么。
-
(4) 试管中收集气体是,如果要在A处玻璃管处点燃该气体,则必须对该气体进行 。
硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O],其相对分子质量为392,在空气中不易被氧化,易溶于水,不溶于乙醇,100℃时易失去结晶水。现用FeSO4溶液与(NH4)2SO4反应,制取硫酸亚铁铵晶体,其流程如图所示:

-
(1) “混合反应”时温度需控制在70~80℃,可采取的措施是,该过程中乙醇的作用是。
-
(2) 现对制得的硫酸亚铁铵晶体进行纯度测定:准确称取4.000g上述硫酸亚铁铵晶体置于锥形瓶中溶解,加适量稀硫酸酸化,用0.100mol·L-1标准KMnO4溶液进行反应,当
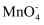 恰好完全被还原为Mn2+时,消耗KMnO4溶液的体积为20.00mL。
恰好完全被还原为Mn2+时,消耗KMnO4溶液的体积为20.00mL。 已知:
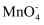 +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O①若用稀盐酸替代稀硫酸进行酸化,则实际消耗的标准KMnO4溶液的体积20.00mL。(填“大于”或“小于”或“等于”)
②试通过计算,求该硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]的纯度(写出计算过程)
某学生以铁丝和Cl2为原料进行下列三个实验。从分类角度分析,下列选项正确的是( )
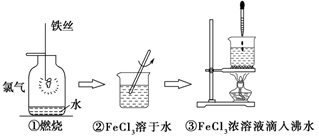
A . 实验①、③反应制得的物质均为纯净物
B . 实验②、③均未发生氧化还原反应
C . 实验①、③均为放热反应
D . 实验①、②所涉及的物质均为电解质
下列实验方法操作,能达到要求的是( )
A . 用托盘天平称量25.20g氯化钠固体
B . 金属钠着火燃烧时,用泡沫灭火器灭火
C . 用一束强光照射经过煮沸的三氯化铁溶液有光亮的通路,说明已生成氢氧化铁胶体
D . 过量的铁丝在氯气中点燃,可制取氯化亚铁
某学生以铁丝和Cl2为原料进行下列三个实验。从分类角度分析,下列选项正确的是( )
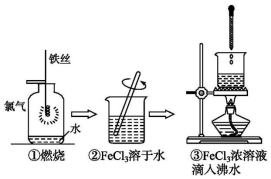
A . 实验①、③反应制得的物质均为纯净物
B . 实验②、③均未发生氧化还原反应
C . 实验③制备氢氧化铁胶体需要加热煮沸至生成红褐色沉淀
D . 实验①、②所涉及的物质均为电解质
某工业废水含大量的FeSO4,较多的Cu2+和少量的K+。某工厂计划回收金属铜并制取硫酸亚铁,流程如下图,相关分析错误的是( )
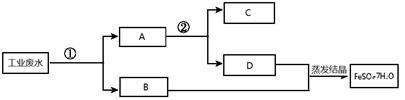
A . 步骤①加入过量Fe粉后过滤,分别得到固体A和滤液B
B . 步骤②所加试剂是稀盐酸
C . 蒸发结晶时有大量晶体析出就停止加热
D . 取少量步骤①所得溶液B于试管中,先加入盐酸酸化,再加入BaCl2溶液,有白色沉淀生成,表明溶液B中含SO42-
下列说法错误的是( )
A . 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4
B . 氯气能使湿润的淀粉碘化钾试纸变蓝,说明Cl2具有氧化性
C . 实验室一般通过加热NH4Cl制备氨气
D . “84”消毒液的有效成分为NaClO,它与洁厕灵(主要成分为盐酸)混合会生成氯气
下列化学方程式或离子方程式书写正确的是( )
A . 浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B . 向饱和NaOH溶液中通入过量CO2:2OH-+CO2=CO  +H2O
C . 铁与水蒸气反应:3Fe+4H2O(g)
+H2O
C . 铁与水蒸气反应:3Fe+4H2O(g)  Fe3O4+4H2
D . 向氢氧化钡溶液中滴加稀硫酸:Ba2++SO
Fe3O4+4H2
D . 向氢氧化钡溶液中滴加稀硫酸:Ba2++SO  =BaSO4↓
=BaSO4↓
 +H2O
C . 铁与水蒸气反应:3Fe+4H2O(g)
+H2O
C . 铁与水蒸气反应:3Fe+4H2O(g)  Fe3O4+4H2
D . 向氢氧化钡溶液中滴加稀硫酸:Ba2++SO
Fe3O4+4H2
D . 向氢氧化钡溶液中滴加稀硫酸:Ba2++SO  =BaSO4↓
=BaSO4↓
类推是一种重要的学习方法,但有时会产生错误的结论。下列类推结论正确的是( )
①镁条在氧气中燃烧生成MgO,故钠在氧气中燃烧生成Na2O
②活泼金属钠、钾保存在煤油中,故活泼金属锂也保存在煤油中
③铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜
④常温下,铝能被稀硝酸溶解,故也能被浓硝酸溶解。
A . ①②
B . ②③
C . ③④
D . 无符合题意推理
如图转化过程中错误的是( )

A . ①
B . ②
C . ③
D . ④
下列有关铁及其化合物的说法正确的是( )
A . 铁与水蒸气在高温下的反应产物为Fe2O3和H2
B . 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
C . 配制FeSO4溶液时,可在溶液中加入少量铁粉
D . 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入Cu粉,然后过滤
港珠澳大桥建设过程中水泥的使用量约198万吨。水泥熟料的主要成分为CaO、SiO2 , 并含有一定量的铁、铝等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示。下列叙述正确的是( )
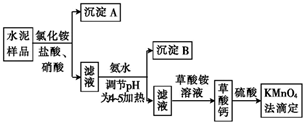
A . 水泥、玻璃、陶瓷均为传统的硅酸盐材料,三者的原料都主要为SiO2
B . 沉淀A的主要成分为SiO2 , 沉淀B为Fe(OH)3、Al(OH)3
C . KMnO4法滴定时发生反应的离子方程式为2MnO  +5C2O
+5C2O  +6H+=2Mn2++10CO2↑+8H2O
D . 草酸钙易溶于水
+6H+=2Mn2++10CO2↑+8H2O
D . 草酸钙易溶于水
 +5C2O
+5C2O  +6H+=2Mn2++10CO2↑+8H2O
D . 草酸钙易溶于水
+6H+=2Mn2++10CO2↑+8H2O
D . 草酸钙易溶于水
最近更新



