镁的化学性质 知识点题库
某同学通过系列实验探究Mg及其化合物的性质,操作正确且能达到目的的是( )
A . 将水加入浓硫酸中得到稀硫酸,置镁片于其中探究讨Mg的活泼性
B . 将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成
C . 将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
D . 将Mg(OH)2沉淀转入蒸发皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体
下列各组物质与其用途的关系不正确的是( )
A . 过氧化钠﹣﹣供氧剂
B . 金属镁﹣﹣制照明弹
C . 苏打﹣﹣发酵粉主要成分
D . 明矾﹣﹣净水剂
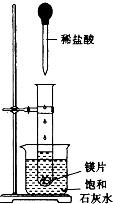
如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答:
-
(1) 实验中观察到的现象是 .
A . 试管中镁片逐渐溶解 B . 试管中产生无色气泡 C . 烧杯外壁变冷 D . 烧杯底部析出少量白色固体 -
(2) 试管中发生的反应属于(选填“氧化还原反应”或“非氧化还原反应”).
-
(3) 写出有关反应的离子方程式.
-
(4) 由实验推知,MgCl2溶液和H2的总能量(填“大于”“小于”“等于”)镁片和盐酸的总能量.
将23g钠和24g镁分别放入等质量的过量的稀硫酸中,得到溶液的质量分别为a g和b g (设反应中水分不损失)则a和b的关系为( )
A . a<b
B . a>b
C . a=b
D . 无法确定
某同学在实验室利用氢氧化钠、盐酸分离铁粉和铝粉混合物,物质转化关系如图所示:

下列说法不正确的是( )
A . x为NaOH溶液,y为盐酸
B . a→b发生的反应为:AlO2﹣+H++H2O═Al(OH)3↓
C . b→c→Al的反应条件分别为:加热、电解
D . a、b、c既能与酸又能与碱反应
下列说法中错误的是( )
A . 钠在空气中燃烧时,先熔化,再燃烧,产物为Na2O2
B . 镁在空气中形成一层致密的氧化膜,故镁不需要像钠那样的特殊保护
C . 铝制品在生活中非常普遍,是因为铝不活泼
D . 铁在潮湿的空气中生成的氧化物疏松多孔,不能保护内层金属,故铁制品往往需要涂保护层
下列实验现象与书写的化学方程式相吻合的是( )
A . 有大量白雾产生的反应:4P+5O2  2P2O5
B . 有白色沉淀生成的反应:2Mg+O2
2P2O5
B . 有白色沉淀生成的反应:2Mg+O2  2MgO
C . 有溶液颜色变化的反应:Zn+2HCl═ZnCl2+H2↑
D . 黑色固体变成红色固体的反应:CuO+CO
2MgO
C . 有溶液颜色变化的反应:Zn+2HCl═ZnCl2+H2↑
D . 黑色固体变成红色固体的反应:CuO+CO  Cu+CO2
Cu+CO2
 2P2O5
B . 有白色沉淀生成的反应:2Mg+O2
2P2O5
B . 有白色沉淀生成的反应:2Mg+O2  2MgO
C . 有溶液颜色变化的反应:Zn+2HCl═ZnCl2+H2↑
D . 黑色固体变成红色固体的反应:CuO+CO
2MgO
C . 有溶液颜色变化的反应:Zn+2HCl═ZnCl2+H2↑
D . 黑色固体变成红色固体的反应:CuO+CO  Cu+CO2
Cu+CO2
下列各物质,能由单质间发生化合反应得到,但不能由单质与酸发生置换反应得到的是( )
A . MgCl2
B . FeCl3
C . AlCl3
D . CuCl2
镁、铝在生产生活中有广泛的应用.回答下列问题:
-
(1) 铝的原子结构示意图为.它位于元素周期表的第周期,第族.
-
(2) 实验室制备氢氧化铝的常用方法是在氯化铝溶液中滴加氨水,反应的离子方程式为.
-
(3) 常温下,铁跟水不反应,但红热的铁会跟水蒸气发生反应,反应的化学方程式为.
-
(4) 检验某溶液中是否含有Fe3+的操作方法是.
把镁铝合金用稀硫酸溶解,加入氢氧化钠溶液的体积与生成沉淀的质量关系如右图,则合金中镁和铝的质量比是( )

A . 1:1
B . 8:9
C . 4:3
D . 4:9
将镁铝合金溶于100mL稀硝酸中,产生1.12LNO气体(标准状况),向反应后的溶液中加入NaOH溶液,产生沉淀情况如图所示。下列说法错误的是( )
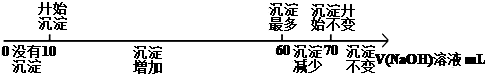
A . 可以求出合金中镁的质量
B . 氢氧化钠溶液浓度为3mol/L
C . 可以求出沉淀的最大质量
D . 不能求出硝酸的物质的量浓度
ag Mg、Al合金完全溶解在C1mol/L、V1LHCl溶液中,产生bmolH2。再向反应后的溶液中加入C2mol/LV2L NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为dg。下列关系错误的是( )
A . d=a+34b
B .  C . 铝的质量为
C . 铝的质量为 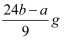 D . 与金属反应后剩余盐酸为(C1V1-2b)mol
D . 与金属反应后剩余盐酸为(C1V1-2b)mol
 C . 铝的质量为
C . 铝的质量为 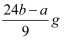 D . 与金属反应后剩余盐酸为(C1V1-2b)mol
D . 与金属反应后剩余盐酸为(C1V1-2b)mol
将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L-1的盐酸反应,实验测得生成气体的体积V (已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是( )

A . x=2.24
B . 曲线b为Mg与盐酸反应的图象
C . 反应时,Na、Mg、Al均过量
D . 钠的物质的量为0.2 mol
下列说法错误的是( )
A . 镁常用于制造信号弹和焰火
B . 碘化银和干冰常用于人工降雨
C . 二氧化硅常用于制造太阳能电池
D . 钠不慎着火时,不能用泡沫灭火剂灭火
镁、铝合金粉末 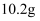 溶于
溶于 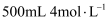 盐酸中且恰好完全反应,若加入
盐酸中且恰好完全反应,若加入  的氢氧化钠溶液,使得沉淀达到最大量,则需加入氢氧化钠溶液的体积为( )
的氢氧化钠溶液,使得沉淀达到最大量,则需加入氢氧化钠溶液的体积为( )
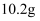 溶于
溶于 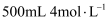 盐酸中且恰好完全反应,若加入
盐酸中且恰好完全反应,若加入  的氢氧化钠溶液,使得沉淀达到最大量,则需加入氢氧化钠溶液的体积为( )
的氢氧化钠溶液,使得沉淀达到最大量,则需加入氢氧化钠溶液的体积为( )
A .  B .
B . 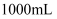 C .
C . 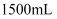 D .
D . 
 B .
B . 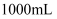 C .
C . 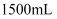 D .
D . 
下列说法中不正确的是( )
A . 可用分液漏斗分离乙酸乙酯和饱和碳酸钠溶液
B . 镁着火,不能用CO2灭火
C . 毛料与棉布可以通过燃烧闻气味的方法进行鉴别
D . 容量瓶使用前必须检漏,洗涤,干燥
4.6 g铜镁合金完全溶解于100 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到4480 mL NO2和336 mL N2O4 的混合气体(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液至离子恰好全部沉淀时,下列说法错误的是( )
A . 该合金中铜与镁的物质的量之比是2:3
B . 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C . 产生沉淀8.51 g
D . 离子恰好完全沉淀时,加入NaOH溶液的体积是230 mL
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积。该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下:

①用已知浓度的浓盐酸配制100mL 1.0mol/L的盐酸(需要用到的仪器有量筒、烧杯、……….);
②用10mL的量筒量取8.0mL 1.0mol/L的盐酸加入锥形瓶中;
③准确称取ag已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为……….;
④向广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为VmL。
请回答下列问题:
-
(1) 步骤①中,配制100mL1.0mol/L的盐酸时,下列会使所配制溶液的浓度偏低的操作有(填序号)。
A 用量筒量取浓盐酸时,俯视量筒的刻度线
B 容量瓶未干燥即用来配制溶液
C 浓盐酸在烧杯中稀释时,搅拌时间过长
D 定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线,未做处理
E 在容量瓶中定容时俯视容量瓶刻度线
F 烧杯中有少量水
G 未冷却至室温即定容
-
(2) 请填写操作步骤中的空格:
步骤①:;步骤③:。
-
(3) 步骤⑤中应选用的量筒规格是。
-
(4) 读数时需要注意(至少写两点):。
-
(5) 忽略水蒸气的影响,在该条件下测得的气体摩尔体积Vm=L/mol。
-
(1) 绿矾的化学式是。
-
(2) 热稳定性H2O大于H2S的主要原因是。
-
(3) 写出镁在二氧化碳中燃烧的化学反应方程式:。
恒温条件下,向两个锥形瓶中加入等质量、表面积相同的镁条并塞紧瓶塞,然后用注射器分别注入 盐酸、
盐酸、 醋酸,测得锥形瓶内气体压强随时间变化如图,反应过程中忽略液体体积变化.下列说法不正确的是( )
醋酸,测得锥形瓶内气体压强随时间变化如图,反应过程中忽略液体体积变化.下列说法不正确的是( )
 盐酸、
盐酸、 醋酸,测得锥形瓶内气体压强随时间变化如图,反应过程中忽略液体体积变化.下列说法不正确的是( )
醋酸,测得锥形瓶内气体压强随时间变化如图,反应过程中忽略液体体积变化.下列说法不正确的是( )
A . 加入的镁条质量可能为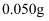 B .
B . 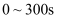 内,两锥形瓶中反应平均速率相等
C . 反应结束,反应体系(反应物、生成物、锥形瓶)总能量升高,环境总能量降低
D . 将醋酸中的镁条替换为等质量的镁粉,曲线②有可能变化为曲线①
内,两锥形瓶中反应平均速率相等
C . 反应结束,反应体系(反应物、生成物、锥形瓶)总能量升高,环境总能量降低
D . 将醋酸中的镁条替换为等质量的镁粉,曲线②有可能变化为曲线①
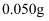 B .
B . 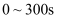 内,两锥形瓶中反应平均速率相等
C . 反应结束,反应体系(反应物、生成物、锥形瓶)总能量升高,环境总能量降低
D . 将醋酸中的镁条替换为等质量的镁粉,曲线②有可能变化为曲线①
内,两锥形瓶中反应平均速率相等
C . 反应结束,反应体系(反应物、生成物、锥形瓶)总能量升高,环境总能量降低
D . 将醋酸中的镁条替换为等质量的镁粉,曲线②有可能变化为曲线①
最近更新



