镁的化学性质 知识点题库
镁和铝分别与等浓度、等体积的足量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。反应中镁和铝的( )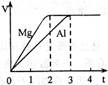
A . 物质的量之比为3:2
B . 质量之比为3:2
C . 转移电子数之比为3:2
D . 反应速率之比为2:3
把23g钠投入到m1g足量的水中得到ag溶液,把24g镁投入到m2g足量的盐酸中得到bg溶液,若m1=m2 , 则a , b的关系是( )
A . a>b
B . a<b
C . a=b
D . 无法确定
将2.4g合金投入足量的稀硫酸中放出2.24L气体(标准状况),该合金可能是( )
A . 镁铝合金
B . 铝锌合金
C . 铁锌合金
D . 硅铁合金
在CO2中,Mg燃烧生成MgO和C.下列说法正确的是( )
A . 该反应属于置换反应
B . 12C和14C是碳元素的两种同素异形体
C . 该反应中化学能全部转化为热能
D . 在该反应条件下,C的还原性强于Mg的还原性
类推的思想方式在化学学习与研究中经常被采用,但类推出的结论是否正确最终要经过实验的验证.以下类推的结论中正确的是( )
A . SO2能使酸性KMnO4溶液褪色,故CO2也能使酸性KMnO4溶液褪色
B . 常温下浓硫酸能使铁和铝钝化,故常温下浓硝酸也能使铁和铝钝化
C . SO2能使品红溶液褪色,故CO2也能使品红溶液褪色
D . 盐酸与镁反应生成氢气,故硝酸与镁反应也生成氢气
某同学通过系列实验探究Mg及其化合物的性质,操作正确且能达到目的是( )
A . 将水加入浓硫酸中得到稀硫酸,置镁片于其中探究讨Mg的活泼性
B . 将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成
C . 将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
D . 将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体
下列说法错误的是( )
A . 钠在空气中燃烧最后所得产物为Na2O2
B . 镁因在空气中形成了一层致密的氧化膜,保护了里面的镁,故镁不需要进行特殊保护
C . 铝制品在生活中非常普遍,这是因为铝不活泼
D . 铁在潮湿的空气中因为生成的氧化膜很疏松不能保护内层金属,故铁制品往往需涂保护层
将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( )
A . 4 mol·L-1 HNO3
B . 3 mol·L-1HCl
C . 8 mol·L-1 NaOH
D . 18 mol·L-1 H2SO4
-
(1) 写出Mg在CO2中燃烧的化学方程式。
-
(2) 最近报纸上报导了有人混用洗涤剂发生了中毒事件,当事人先用洁厕灵(强酸性,含盐酸)洗卫生间,再用84消毒液(含NaClO)进行杀菌。
请写出涉及反应的离子方程式。
-
(3) 碱金属能形成离子型氢化物。如氢化钠的化学式为NaH,其中H-具有较强的还原性。
常用NaH在高温下将TiCl4还原成Ti,反应的化学方程式为。
NaH能与水剧烈反应生成对应的碱和氢气,该反应中氧化产物和还原产物的质量比为。
金属及其化合物的转化关系是化学学习的重要内容之一。下列各组物质的转化不能通过一步反应直接完成的是()
A . Al→Al2O3→Al(OH)3→AlCl3
B . Fe→FeSO4→Fe(OH)2→Fe(OH)3
C . Mg→MgCl2→Mg(OH)2→MgSO4
D . Na→NaOH→Na2CO3→NaCl
实验室用镁和硝基苯制取反式偶氮苯(溶解性:不溶于水,溶于醇、醚)。实验原理如下:
2 ![]() +4Mg+8CH3OH→
+4Mg+8CH3OH→ 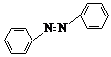 +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
已知:①Mg(OCH3)2在水中极易水解。
②反式偶氮苯产品在紫外线照射后部分转化为顺式偶氮苯。
-
(1) 反应中,硝基苯变为反式偶氮苯的反应属于_______________A . 取代反应 B . 消去反应 C . 还原反应 D . 氧化反应
-
(2) 在反应装置中,加入原料及溶剂,搅拌下加热回流。反应加入的镁条应用砂纸打磨干净的原因是。
图1
 图2
图2 
-
(3) 反应结束后将反应液倒入冰水中,用乙酸中和至中性,即有反式偶氮苯粗产品析出,抽滤(抽滤装置如图1),滤渣用95%乙醇水溶液重结晶提纯。
①为了得到较大颗粒的晶体,加入乙酸时需要(填“缓慢加入”、“快速加入”)。
②抽滤过程中要洗涤粗产品,下列液体最合适的是。
A.乙醚 B.蒸馏水 C.95%乙醇水溶液 D.饱和NaCl溶液
③重结晶操作包括“加热溶解、趁热过滤、冷却结晶、抽滤、洗涤、干燥”。上述重结晶过程中的操作除去了不溶性杂质,操作除去了可溶性杂质。
为测定含镁3%~5%的铝镁合金中镁的质量分数,设计了2种实验方案,说法错误的是( )
方案一:镁铝合金加入足量的氢氧化钠溶液中充分反应后过滤,测定剩余固体质量;
方案二:称量m g铝镁合金粉末,放在图中惰性电热板上,通电使其充分灼烧。测得固体质量增重。

A . 方案一中若称取5.4 g合金粉末样品,投入V mL 2.0 mol/L NaOH溶液中反应,则V≥100 mL
B . 方案一中测定剩余固体质量时,过滤后未洗涤固体就干燥、称量,则镁的质量分数偏高
C . 方案二中欲计算镁的质量分数,实验中还需测定灼烧后固体的质量
D . 方案二中若用空气代替O2进行实验,则测定结果偏高
化学与生活关系非常密切,下列关于生活中的化学叙述正确的是( )
A . 金属镁着火后,可以用灭火器中的干粉扑灭
B . 玉坠的主要成分是二氧化硅
C . 聚乙烯、聚氯乙烯都是高分子材料,对环境的影响是形成白色污染
D . 含碘食盐中含有KI,可以预防地方性甲状腺肿大
相同物质的量的钠、镁、铝与过量的稀硫酸反应,在标况下产生氢气的体积比是( )
A . 1:1:1
B . 1:2:3
C . 6:3:2
D . 23:24:27
镁在空气中燃烧除生成MgO外,还可能生成Mg3N2。某校化学兴趣小组的同学利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成。
-
(1) 甲组同学取一定量燃烧后的固体投入水中,得到了一种能使湿润的红色石蕊试纸变蓝 的气体,该气体的化学式为,说明固体中含有Mg3N2 , 生成该气体的化学反应方程式为。
-
(2) 乙组同学为测定Mg3N2含量,用图示装置进行实验,充分反应后再加热A。其中浓硫酸的作用是,对A加热的目的是。已知加入的固体质量为4.0g,最终C装置增重ag,则固体中含Mg3N2 g(用含a的式子表示)。

-
(3) 丙组有的同学认为乙组同学的测定结果偏高,理由是。
有的同学认为乙组同学的测定结果偏低,理由是。
丙组同学进行了改进,他们将乙组同学实验中得到的难溶固体进行过滤、洗涤、干燥,并灼烧固体至恒重,测得其质量为4.08g。上述过程中,洗涤沉淀的操作是。
镁在空气中燃烧后生成的固体中Mg3N2的质量分数为。
-
(4) 有一种用铵盐与含镁矿石混合煅烧制取氧化镁的方法,解决了现有方法存在的原料成 本高、项目投资大、能耗高、副产品不好用等问题,其原理是将含镁矿石粉(含氧化镁)与 铵盐混合,经过煅烧、水溶、过滤,得到粗镁盐溶液,并回收煅烧产生的氨。写出用固体(NH4)2SO4与含镁矿石粉煅烧的化学反应方程式。
同体积的1mol/L的HCl、H2SO4、CH3COOH、HNO3分别加入过量的Mg。下列叙述正确的是( )
A . HNO3、HCl、H2SO4中放出H2的速率相同
B . HCl、HNO3中放出H2的量相等
C . HCl、CH3COOH中放出H2的量相等
D . H2SO4中放出H2的量最多,其余的相等
铜和镁的合金4.6 g完全溶于浓硝酸,若反应中硝酸被还原只产生4 480 mL NO2气体和336 mL的N2O4气体(气体的体积已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为 ( )
A . 9.02 g
B . 8.51 g
C . 8.26 g
D . 7.04 g
下列说法不正确的是( )
A . 金属镁的密度小、硬度大,因此被用于制造飞机的部件等
B .  吸收
吸收  产生
产生  ,可用作呼吸面具供氧剂
C . 水玻璃是建筑行业常用的一种黏合剂和木材的防火剂
D . “火树银花”中的焰火实质上是金属元素的焰色反应
,可用作呼吸面具供氧剂
C . 水玻璃是建筑行业常用的一种黏合剂和木材的防火剂
D . “火树银花”中的焰火实质上是金属元素的焰色反应
 吸收
吸收  产生
产生  ,可用作呼吸面具供氧剂
C . 水玻璃是建筑行业常用的一种黏合剂和木材的防火剂
D . “火树银花”中的焰火实质上是金属元素的焰色反应
,可用作呼吸面具供氧剂
C . 水玻璃是建筑行业常用的一种黏合剂和木材的防火剂
D . “火树银花”中的焰火实质上是金属元素的焰色反应
下列说法错误的是( )
A . 金属镁常被用于制造信号弹和焰火
B . 高炉炼铁的原理:Fe2O3+3C  2Fe+3CO
C . 晶体硅是一种半导体材料,应用于电子工业
D . 二氧化硫可用于漂白纸浆及草帽等编织物
2Fe+3CO
C . 晶体硅是一种半导体材料,应用于电子工业
D . 二氧化硫可用于漂白纸浆及草帽等编织物
 2Fe+3CO
C . 晶体硅是一种半导体材料,应用于电子工业
D . 二氧化硫可用于漂白纸浆及草帽等编织物
2Fe+3CO
C . 晶体硅是一种半导体材料,应用于电子工业
D . 二氧化硫可用于漂白纸浆及草帽等编织物
下列有关金属材料说法正确的是( )
A . 碳钢与生铁的主要成分相同,所以性能相同
B . 通常合金的硬度比其成分金属的小
C . 铝的化学性质稳定,所以铝制品耐腐蚀
D . 镁在空气中燃烧发出耀眼的白光,可用作照明弹
最近更新



