两性氧化物和两性氢氧化物 知识点题库
化学与社会、生活密切相关,对下列现象或事实的解释正确的是( )
选项 | 现象或事实 | 解释 |
A | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化放出大量的热 |
B | 用氢氟酸蚀刻玻璃 | SiO2是碱性氧化物,能溶于酸 |
C | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
D | 用浸有酸性高锰酸钾溶液的硅藻 土作水果保鲜剂 | 酸性高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
A . A
B . B
C . C
D . D
下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②Al2O3③Al(OH)3 ④Al
A . ③④
B . ②③
C . ①③④
D . 全部
下列物质中,既能和酸反应又能和碱反应的化合物是( )
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3 .
A . ②③④
B . ①②④
C . ①②③④
D . ①③④
某氧化物不溶于水,溶于熔化的NaOH中,生成易溶于水的化合物,向稀盐酸中滴加所生成化合物的水溶液,立即有白色沉淀产生,则原氧化物是( )
A . Al2O3
B . MgO
C . SiO2
D . Fe2O3
有五种化合物:①Mg(HCO3)2 , ②Al(OH)3 , ③Al,④(NH4)2CO3 , ⑤Al2O3 . 跟盐酸和NaOH溶液都能反应的物质有( )
A . 二种
B . 三种
C . 四种
D . 五种
下列操作可得纯净Al2O3的是( )
A . 向NaAlO2溶液中加入适量的稀硫酸后,蒸干并灼烧
B . 向NaAlO2溶液中通入过量的CO2后,过滤并灼烧
C . 向AlCl3溶液中加入适量的NaAlO2溶液后,蒸干并灼烧
D . 向AlCl3溶液中加入过量的NaOH溶液后,过滤并灼烧
下列各组中两种物质作用时,反应条件或反应物用量改变,对生成物没有影响的是( )
A . Na与O2
B . NaOH溶液与CO2
C . Na2O2与CO2
D . AlCl3溶液与NaOH溶液
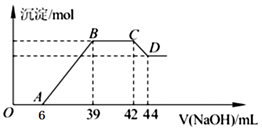
将一定量的Al2O3固体加入100mLNaOH溶液中,固体全部溶解,向所得溶液中逐滴加入1.0 mol•L-1盐酸,所得沉淀的物质的量与加入盐酸体积的关系如图所示(不考虑溶液体积的变化),则下列说法正确的是( )
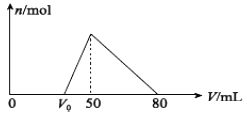

A . 原NaOH溶液的浓度为1.0mol/L
B . 原Al2O3的质量为0.51g
C . V0的数值为35
D . 沉淀量达到最大时,溶液的溶质有两种
醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
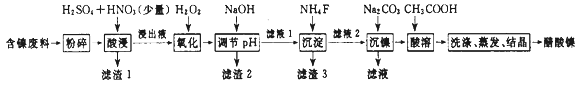 相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
金属离子 | 开始沉淀时的pH | 沉淀完全时的pH | 物质 | 20℃时溶解性(H2O) | |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 | |
Fe2+ | 5.8 | 8.8 | NiF | 可溶 | |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=1.0×10-5 |
-
(1) 将含镍废料粉碎的目的是。
-
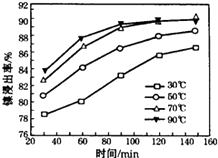
(2) “酸浸”实验中,镍的浸出率结果如图所示,从能量损耗和成本角度考虑,若要使镍的浸出效果最佳,选择的最好温度和时间分别为℃、 min。
-
(3) 实验过程中,滤渣1主要成分的化学式为、。
-
(4) 调节pH步骤中,溶液pH的调节范围是~。选择此范围的目的是。
-
(5) 酸浸过程中,1mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:。
-
(6) 沉镍过程中,若c(Ni2+)=4.0 mol·L-1 , 欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为g。(保留小数点后1位有效数字)
下列化合物既能与稀盐酸反应又能与NaOH溶液反应的是( )
①Al ②NH4)2CO3 ③Al2O3 ④Ca(HCO3)2 ⑤AgNO3 ⑥Al(OH)3
A . ①②③④⑤⑥
B . ②③④⑥
C . ②③④⑤⑥
D . ①②③⑥
下列属于酸性氧化物的是( )
A . Al2O3
B . SiO2
C . CO
D . KClO3
用如图所示装置(夹持仪器省略)进行实验,将液体A逐渐加入固体B中。回答下列问题:

-
(1) 图中D装置在实验中的作用;
-
(2) 若A中为浓盐酸,B中为高锰酸钾,C中盛有KI淀粉溶液,旋开E后,C中的现象是溶液变蓝色,试写出A与B反应的化学方程式:
-
(3) 若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E足够长的时间后,C中的现象是,C中发生反应的化学方程式为:;
既能跟盐酸反应,又能跟氢氧化钠溶液反应的物质是( )
A . CuSO4
B . MgO
C . NaHCO3
D . Fe(OH)3
在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如图所示(b处NaOH的体积为1 L)
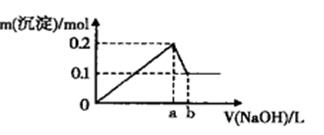
则下列判断正确的是( )
A . 图中线段oa:ab=3:l
B . NaOH溶液物质的量浓度为0.6 mol·L-1
C . 在b点处溶液中的溶质只有NaAlO2
D . 混合溶液中Al3+与Mg2+物质的量比值为2:1
下列物质具有两性,既能与盐酸反应,又能与 NaOH 溶液反应的是( )
A . NaCl
B . CuO
C . MgO
D . Al(OH)3
铝热反应是铝的一个重要性质,该性质用途十分广泛。“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中"。已知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
-
(1) (一)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝溶合形成铁铝合金。你认为他的解释是否合理?(填“合理”或“不合理")。
-
(2) 设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是,反应的离子程式为。
-
(3) 实验室溶解该熔融物,在下列试剂中最适宜的试剂是__________(填序)。A . 浓硫酸 B . 稀硫酸 C . 稀硝酸 D . 氢氧化钠溶液
-
(4) (二)实验研究发现,硝酸发生氧化还原反应时,硝酸的对应还原产物中氮元素存在形式为
 。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入6mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入6mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式:
-
(5) 图中OA段没有沉淀生成,此阶段发生反应的离子方程式为。
-
(6) 在BC段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为;
-
(7) 熔物中铝元素的物质的量为mol;
-
(8) B点对应的沉淀的物质的量为mol。
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2
②向Fe(OH)3胶体中逐滴加入过量的稀盐酸
③向NaAlO2溶液中通入过量的CO2
④向澄清石灰水中通入缓慢过量的CO2
A . ①②
B . ①④
C . ①③
D . ②③
现有下列4种物质:①NO2、②FeCl3、③Al(OH)3、④浓HNO3 . 其中,既能与酸反应又能与碱反应生成盐和水的是(填序号,下同);与水反应产生无色气体的是;遇KSCN溶液显红色的是;常温下能使铁表面生成致密氧化膜的是.
将一定质量的镁铝合金投入一定体积10 mol·L-1的盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的质量与加入NaOH溶液的体积关系如图所示。若不考虑金属和盐酸反应时HCl的挥发,则下列说法错误的是( )
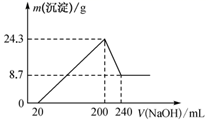
A . 该镁铝合金中铝的质量为5.4 g
B . 所用NaOH物质的量浓度为4.5 mol·L-1
C . 反应中沉淀的物质的量最多时为0.35 mol
D . 溶解合金所用盐酸的体积为100 mL
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
|
叙述I |
叙述II |
|
|
A |
氯气具有强还原性 |
可用于自来水的消毒杀菌 |
|
B |
SiO2导电能力强 |
可用于制造太阳能电池板 |
|
C |
SO2有还原性 |
SO2能使酸性KMnO4溶液褪色 |
|
D |
盐酸和氨水都能溶解Al(OH)3 |
Al(OH)3是两性氢氧化物 |
A . A
B . B
C . C
D . D
最近更新



