两性氧化物和两性氢氧化物 知识点题库

-
(1) 以上设计的两种方案中,合理而又考虑经济效益的是(填编号)。
-
(2) 若提纯时用的原料除铝土矿、水外,还需物质在下列物质中选择:①Na2CO3 , ②CaCO3 , ③H2SO4 , ④HCl,⑤KOH。试写出有关主要反应的化学方程式(是离子反应的要写离子方程式):。
①(NH4)2CO3 ②Al(OH)3 ③NaHCO3 ④Al2O3 ⑤Fe(NO3)2 .
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3 .
①Al ②Al2O3③Al(OH)3④NaHCO3⑤(NH4)2CO3 .
①Al ②AlCl3③Al(OH)3④NaHCO3 .
-
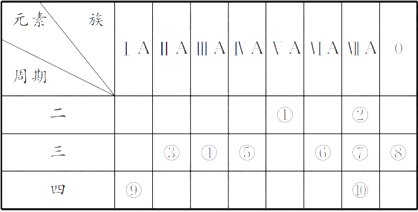
(1) ⑤和⑧的元素符号分别是和。
-
(2) 表中最活泼的金属是,非金属性最强的元素是(填元素符号,下同)。
-
(3) 表中能形成两性氢氧化物的元素是,分别写出该元素的氢氧化物与⑥和⑨的最高价氧化物的水化物反应的化学方程式:。
-
(4) 请设计一个实验方案,比较⑦和⑩的单质氧化性的强弱:。
-
(1) I.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时有如下分解反应:2Mg5Al3(OH)19(H2O)4
 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3 除去固体产物中Al2O3的离子方程式为。
-
(2) MgO可溶于NH4Cl溶液的化学方程式为。
-
(3) II.过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体消毒剂。工业生产过程如下: ①在NH4Cl溶液中加入Ca(OH)2 ②不断搅拌的同时加入30% H2O2(弱酸性),生成CaO2•8H2O沉淀 ③经过陈化、过滤、水洗得到CaO2•8H2O,再脱水干燥得到CaO2。
CaO2的电子式为。
-
(4) 可循环使用的物质是。工业生产中常选用过量的反应物是Ca(OH)2而不是H2O2 , 这是因为。
-
(5) 检验CaO2•8H2O是否洗净的操作是。
-
(6) 测定产品中CaO2含量:
取mg样品,与足量稀硫酸反应充分,生成的H2O2用cmol/L的KMnO4溶液滴定,消耗标准液的体积为VmL,则该样品中CaO2质量百分数为(含m、C、V的表达式)。
① NaHCO3 ② Al2O3 ③ NaAlO2 ④ Al ⑤(NH4)2CO3 ⑥ AlCl3 ⑦ Al(OH)3
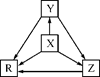
| 选项 | X | Y | Z | R |
| A | Al | AlCl3 | Al(OH)3 | NaAlO2 |
| B | Na | Na2O | Na2O2 | NaOH |
| C | H2S | S | SO2 | SO3 |
| D | N2 | NH3 | NO | NO2 |
①常温常压下,17 g甲基(-14CH3)所含的中子数为9NA
②向氯水中加入碳酸钙粉末,能提高溶液中HClO的浓度
③0℃,101 kPa,含有1mol硫原子的SO2与SO3的混合物,其体积小于22.4 L
④向SiO2固体中滴加NaOH溶液或氢氟酸,固体均溶解,说明SiO2是两性氧化物
⑤氯气可置换出碘化钾溶液中的碘,氟气也可置换出碘化钾溶液中的碘
⑥加入铝粉能放出H2的溶液中,Ca2+、Fe2+、Cl-、  一定能够大量共存
一定能够大量共存
⑦常温下,铝可溶于过量浓硝酸,也可溶于过量NaOH溶液
⑧1 mol BrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子的物质的量为1 mol
碱性氧化物 | 酸 | 盐 | 混合物 | 电解质 | |
A | CaO | HNO3 | 纯碱 | 漂白粉 | NaCl |
B | NO | NaHSO4 | NaOH | 碱石灰 | 蔗糖 |
C | Na2O2 | Al(OH)3 | NaHCO3 | CuSO4·5H2O | NH3 |
D | SO2 | HClO | 烧碱 | Fe(OH)3胶体 | H2O |



