氮气的化学性质 知识点题库
下列物质的变化,不能通过一步化学反应完成的是( )
A . N2→NH3
B . SiO2→Na2SiO3
C . Na2O2→Na2CO3
D . SiO2→H2SiO3
下列关于物质性质的叙述中,正确的是( )
A . N2是大气中的主要成分之一,雷雨时,可直接转化为NO2
B . 硫是一种淡黄色的能溶于水的晶体,既有氧化性又有还原性
C . Cl2能与金属活动顺序表中大多数金属反应
D . 硅是应用广泛的半导体材料,常温下化学性质非常活泼
在下列所示的转化关系中,X不可能是( )
x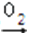 氧化物
氧化物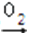 氧化物
氧化物
A . N2
B . H2
C . S
D . C
氮气在常况下是一种无色无味无臭的气体,切无毒.氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
-
(1) 氮气的结构式: ;氮元素原子的L层电子数为
-
(2) 氮化镁与水反应的化学方程式为
-
(3) NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为
-
(4) SO2和NO2是形成酸雨的主要物质.某学习小组学生通过实验探究NO参与的硫酸型酸雨的形成.他们在烧瓶中充入含有少量一氧化氮气体,慢慢充入氧气.请推断该过程中发生反应的化学方程式为 、 ,若用蒸馏水可得硫酸型酸雨,其中一氧化氮的作用为
-
(5) 工业上用碳酸钠溶液浸泡锅炉水垢,使其中硫酸钙能转化为碳酸钙,再用酸出去碳酸钙,其理由是
N2是空气的重要组成部分,因此有科学家依据蒸汽机的原理,设计制造出液氮蒸汽机,即利用液态氮的蒸发来驱动机车,从而达到环境保护的目的,其原理主要依据是( )
A . 液氮的沸点为﹣195.8℃,远低于常温
B . N2在空气中燃烧放热
C . N2的化学性质很稳定
D . N2在空气中的体积分数为78%
亚硝酸钠(NaNO2)在漂白、电镀等方面应用广泛。以木炭浓硝酸、水和铜为原料制备亚硝酸钠的装置如图所示:
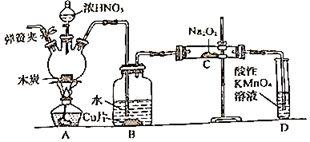
已知:
室温下,①2NO+Na2O2=2NaNO2
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O
③酸性条件下,NO或NO2ˉ都能与MnO4ˉ反应生成NO3ˉ和Mn2+
回答下列问题:
-
(1) 检查完该装置的气密性,装入药品后,实验开始前通入一段时间N2 , 然后关闭弹簧夹,再滴加浓硝酸,加热。通入N2的作用是。
-
(2) 装置B中观察到的主要现象为,发生反应离子方程式是。
-
(3) 装置D的作用是,发生反应的离子方程式是。
-
(4) 预测C中反应开始阶段,固体产物除NaNO2外,还含有的副产物有Na2CO3和(写化学式)。为避免产生这些副产物,应在装置B、C间增加干燥管,则干燥管中盛放的试剂为(写名称)。
-
(5) 利用改进后的装置将3.12gNa2O2完全转化为NaNO2 , 理论上至少需要木炭g
实验室为了更简便地制取NH3 , 下列方法中适合的是( )
A . NH4Cl与浓H2SO4混合共热
B . N2+3H2  2NH3
C . 加热浓氨水
D . 加热NH4HCO3 , 生成的气体用P2O5干燥
2NH3
C . 加热浓氨水
D . 加热NH4HCO3 , 生成的气体用P2O5干燥
 2NH3
C . 加热浓氨水
D . 加热NH4HCO3 , 生成的气体用P2O5干燥
2NH3
C . 加热浓氨水
D . 加热NH4HCO3 , 生成的气体用P2O5干燥
下列物质中,不能由单质直接化合得到的是( )
A . FeS
B . CuS
C . NO
D . NH3
下列说法正确的是( )
A . Na2O2 在空气中久置,因分解成 Na2O 和 O2 而变成白色固体
B . 明矾溶于水能形成胶体,可用于自来水的杀菌消毒
C . 电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
D . 氮气化学性质稳定,可将炽热的镁粉放在氮气中冷却
农业上有一句俗语“雷雨发庄稼”,该过程中不会涉及到的化学反应是( )
A . N2+O2  2NO
B . 2NO+O2 → 2NO2
C . 4NH3+5O2
2NO
B . 2NO+O2 → 2NO2
C . 4NH3+5O2 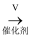 4NO + 6H2O
D . 3NO2+H2O → 2HNO3+NO
4NO + 6H2O
D . 3NO2+H2O → 2HNO3+NO
 2NO
B . 2NO+O2 → 2NO2
C . 4NH3+5O2
2NO
B . 2NO+O2 → 2NO2
C . 4NH3+5O2 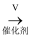 4NO + 6H2O
D . 3NO2+H2O → 2HNO3+NO
4NO + 6H2O
D . 3NO2+H2O → 2HNO3+NO
下列关于氮及其化合物的说法,错误的是( )
A . 铵盐一般都溶于水,且都可分解放出氨气
B . 液氨气化时会吸收大量的热,所以NH3可用作制冷剂
C . 汽车尾气中的氮氧化物是造成光化学烟雾的主要原因之一
D . 工业浓硝酸通常呈黄色,是因为溶解了NO2气体
下列关于常见无机物的应用说法错误的是( )
A . 用[Al2(OH)nCl6-n]m(碱式氯化铝)可除去水体中的悬浮杂质并消毒杀菌
B . 铁粉和炭粉组成的微电池可用于处理工业废水
C . 氨水可用于脱除工业烟气中的二氧化硫
D . 将废铁屑加入氯化亚铁溶液中,可用于除去工业废气中的氯气
在同温同压下,将充有等体积混合而成的四组气体:①NO2+O2;②NO2+NO;③HCl+N2;④SO2+O2 , 分别通入体积相同的试管,并立即倒立于水槽中,如图所示,待试管内液面稳定后,剩余气体体积依次V1、V2、V3、V4 , 则剩余气体体积最多的是( )
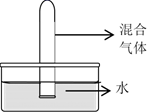
A . V1
B . V2
C . V3
D . V4
下列关于N2的叙述错误的是( )
A . N2既可作氧化剂又可做还原剂
B . 雷雨天,空气中的N2和O2可反应生成NO
C . 氮的固定是将N2转化成含氮化合物
D . 1molN2可与3molH2完全反应生成2molNH3
下列关于氮及其化合物的说法正确的是( )
A . N2分子的结构稳定,因而氮气不能支持任何物质的燃烧
B . 液氨汽化时要吸收大量热,因而液氨可用作制冷剂
C . NO可用向上排空气法或排水法收集
D . 浓硝酸保存在棕色瓶内是因为硝酸易挥发
部分含氮物质的类别与相应氮元素的化合价关系如图所示。下列说法正确的是( )
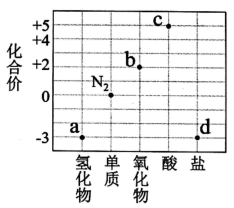
A . a与b在一定条件下可发生反应生成 B . 汽车尾气中的b物质是汽油不完全燃烧导致的
C . 常温下,金属
B . 汽车尾气中的b物质是汽油不完全燃烧导致的
C . 常温下,金属 在c的浓溶液中会钝化
D . 室温时,d的水溶液一定呈酸性
在c的浓溶液中会钝化
D . 室温时,d的水溶液一定呈酸性
 B . 汽车尾气中的b物质是汽油不完全燃烧导致的
C . 常温下,金属
B . 汽车尾气中的b物质是汽油不完全燃烧导致的
C . 常温下,金属 在c的浓溶液中会钝化
D . 室温时,d的水溶液一定呈酸性
在c的浓溶液中会钝化
D . 室温时,d的水溶液一定呈酸性
氮元素在海洋中的循环是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。下列关于海洋中的氮循环的说法正确的是( )

A . 过程①属于化学变化
B . 属于固氮作用的是过程③
C . 反硝化作用是氮元素发生氧化反应
D . 向海洋中排放含 的废水会影响海洋中
的废水会影响海洋中 的含量
的含量
 的废水会影响海洋中
的废水会影响海洋中 的含量
的含量
根据氮及其化合物的转化关系回答下列问题:
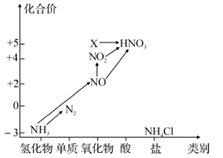
-
(1) X的化学式为,从化合价上看,X 具有性(填“氧化”或“还原”)。
-
(2) 实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为;下列试剂不能用于干燥NH3的是 (填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体 D.无水CaCl2
-
(3) 工业上以NH3、空气、水为原料生产硝酸分为三步:
①NH3→NO的化学方程式为。
②NO→NO2实验现象是。
③NO2+H2O→HNO3氧化剂与还原剂物质的量之比为。
室温下,1体积水能溶解约700体积的NH3。将向下排空气法收集NH3后的试管倒扣在水槽里的水中,观察。对该实验现象的分析正确的是( )

A . 试管内液面上升,证明NH3与H2O发生了反应
B . 试管中剩余少量气体,是因为NH3在水中的溶解达到了饱和
C . 取试管中少量无色液体于另一试管中,向其中加入酚酞溶液,溶液显红色,原因是:NH3 + H2O NH3·H2O
NH3·H2O NH
NH + OH-
D . 将实验后试管中溶液敞口放置在空气中一段时间,pH会降低,主要是由于NH3被空气中的O2氧化
+ OH-
D . 将实验后试管中溶液敞口放置在空气中一段时间,pH会降低,主要是由于NH3被空气中的O2氧化
 NH3·H2O
NH3·H2O NH
NH + OH-
D . 将实验后试管中溶液敞口放置在空气中一段时间,pH会降低,主要是由于NH3被空气中的O2氧化
+ OH-
D . 将实验后试管中溶液敞口放置在空气中一段时间,pH会降低,主要是由于NH3被空气中的O2氧化
下列能使湿润蓝色石蕊试纸先变红后褪色的气体是( )
A . SO2
B . HCl
C . Cl2
D . NH3
最近更新



