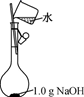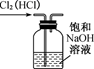氨的实验室制法 知识点题库
哈伯因为氨气的合成曾获1918年诺贝尔奖.
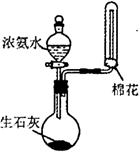
(1)写出实验室由氯化铵和熟石灰加热制取氨气的化学方程式: .检验氨气已装满的方法是:
(2)氨催化氧化的反应方程式:
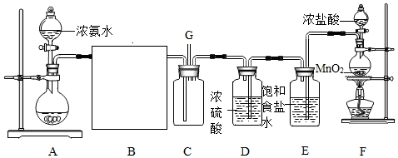
如图所示的实验装置中,A、F分别为NH3和Cl2的发生装置.
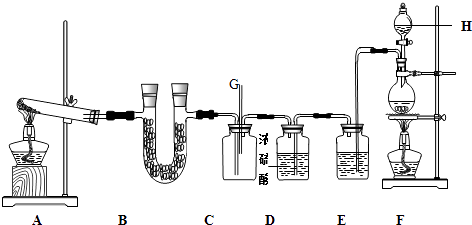
请回答下列问题:
-
(1) 装置F中发生反应的离子方程式为.
-
(2) 甲、乙两同学分别采用下列两种方案制取Cl2:甲:用含HCl 146g的浓盐酸与足量的MnO2反应.乙:用87g MnO2与足量浓盐酸反应.则所得氯气(填字母).
a.甲比乙多b.乙比甲多c.一样多
-
(3) 仪器H的名称是(填名称),装置E的作用是.
-
(4) 装置C的导管G处逸出的尾气中可能含有黄绿色的有毒气体,可用进行尾气处理(填选用试剂的名称).
某学生利用以如图装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.
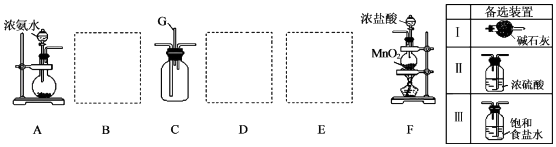
请回答下列问题:
-
(1) 装置F中发生反应的离子方程式为.
-
(2) 装置A中的烧瓶内固体可选用 (填字母).A . 碱石灰 B . 生石灰 C . 二氧化硅 D . 五氧化二磷
-
(3) 虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:B,D,E.
-
(4) 催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质.写出该反应的化学方程式:;该反应中每生成0.5mol N2转移 mol电子.
可以在实验室安全快速制取氨气的方法是( )
A . 在浓氨水中加固体NaOH
B . 混合NH4Cl溶液和NaOH溶液
C . 加热分解NH4Cl晶体
D . 加热消石灰和NH4NO3的固体混合物
有关氨气制取的实验装置如下图所示(夹持装置已略去)下列有关说法正确的是( )
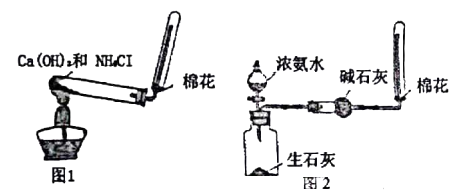
A . 上述两种装置均可收集到纯净的氨气
B . 图1:将固体药品换为碳酸氢铵能制取纯净的氨气
C . 图I:反应原理为Ca(OH)2+2NH4Cl  CaCl2+2NH3↑+2H2O
D . 图2:将湿润的红色石蕊试纸接近试管口处,若试纸变蓝说明已收集满氨气
CaCl2+2NH3↑+2H2O
D . 图2:将湿润的红色石蕊试纸接近试管口处,若试纸变蓝说明已收集满氨气
 CaCl2+2NH3↑+2H2O
D . 图2:将湿润的红色石蕊试纸接近试管口处,若试纸变蓝说明已收集满氨气
CaCl2+2NH3↑+2H2O
D . 图2:将湿润的红色石蕊试纸接近试管口处,若试纸变蓝说明已收集满氨气
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置可以实现该反应。
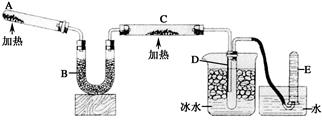
-
(1) A中加入的物质是,发生反应的化学方程式是。
-
(2) B中加入的物质是,其作用是。
-
(3) 实验时在C中观察到的现象是,发生反应的化学方程式是。
-
(4) 实验时在D中观察到的现象是,D中收集到的物质是,检验该物质的方法和现象是。
某研究型学习小组在老师指导下利用以下装置探究氯气与氨气之间的反应情况,其中A,F分别为氨气和氯气的制取发生装置,C为纯净干燥的氯气与干燥的氨气发生反应的装置。请回答下列有关问题:
-
(1) 实验室收集氨气常用的方法是。
-
(2) 请为B处虚线框内选择可能合适的装置以及相应的试剂名称(填序号)。
①球形干燥管装碱石灰 ②洗气瓶装浓硫酸 ③球形干燥管装P2O5
-
(3) 装置F中发生反应的化学方程式为:。若一定体积的浓盐酸中含有4mol HCl 溶质,则加热条件下与足量二氧化锰充分反应后,最终得到的氯气的物质的量 1mol(填>、<或=)。
-
(4) 装置E的作用是除去HCl,使用饱和食盐水而不直接用蒸馏水的原因是。
-
(5) 氰(CN)2的化学性质与卤素单质如Cl2相似,请写出(CN)2与适量KOH溶液发生反应的化学方程式:。
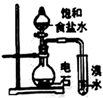
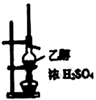
下列装置或操作能达到实验目的的是( )
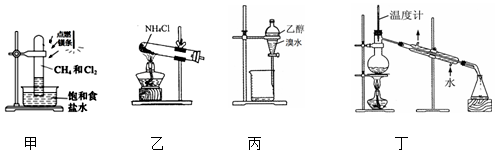
A . 用装置甲制取一氯甲烷
B . 用装置乙在实验室制取氨气
C . 用装置丙萃取溴水中的溴
D . 用装置丁在实验室制蒸馏水
加入NaOH溶液并加热,用湿润pH试纸靠近容器口时,试纸变蓝,这是在检验( )
A . Al3+
B . HCO3-
C . SO42-
D . NH4+
下列实验操作能达到目的是( )
A . 加热氯化铵固体制取氨气
B . 检验乙醇中是否含水:用无水硫酸铜,观察是否变蓝色
C . 除去乙醛中的乙酸杂质:加入氢氧化钠溶液洗涤,分液
D . 滴有酚酞的碳酸钠中,加入氯化钡溶液后,红色变浅,证明碳酸钠溶液中存在水解平衡
实验室制取少量干燥的氨气涉及下列装置,其中正确的是( )
A .  氨气发生装置
B .
氨气发生装置
B .  氨气吸收装置
C .
氨气吸收装置
C . 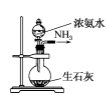 氨气发生装置
D .
氨气发生装置
D . 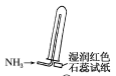 氨气收集、检验装置
氨气收集、检验装置
 氨气发生装置
B .
氨气发生装置
B .  氨气吸收装置
C .
氨气吸收装置
C .  氨气发生装置
D .
氨气发生装置
D .  氨气收集、检验装置
氨气收集、检验装置
如图所示,利用培养皿探究NH3的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )
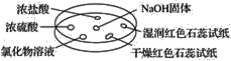
| 选项 | 实验现象 | 解释 |
| A | 浓盐酸附近产生白烟 | NH3与浓盐酸反应产生了NH4Cl固体 |
| B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
| C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
| D | 干燥红石蕊试纸不变色,湿润红石蕊试纸变蓝 | NH3是一种可溶性碱 |
A . A
B . B
C . C
D . D
下列实验操作能达到相应实验目的的是( )
A . 用pH试纸测定新制氯水的pH
B . 用酒精代替CCl4来萃取溴水中的Br2
C . 用向上排气法收集亚硫酸钠与浓硫酸反应产生的SO2
D . 直接加热氯化铵并用向下排气法收集NH3
利用表中药品及图示装置不能制取的气体是( )
| 选项 | 制备气体 | ① | ② | |
| A | NH3 | 浓氨水 | 碱石灰 | |
| B | Cl2 | 浓盐酸 | 二氧化锰 | |
| C | NO2 | 浓硝酸 | 铜粉 | |
| D | SO2 | 浓硫酸 | 亚硫酸钠 |
A . A
B . B
C . C
D . D
下图为实验室制取氨的简易装置示意图。下列说法错误的是( )
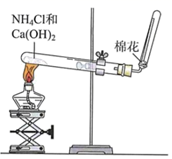
A . 反应的化学方程式为:2NH4Cl + Ca(OH)2  CaCl2 + 2H2O + 2NH3↑
B . 氨的密度比空气小,因此用向下排空气法收集
C . 用湿润的红色石蕊试纸检验反应产生的气体
D . 用蘸有碱液的棉花吸收处理多余的氨
CaCl2 + 2H2O + 2NH3↑
B . 氨的密度比空气小,因此用向下排空气法收集
C . 用湿润的红色石蕊试纸检验反应产生的气体
D . 用蘸有碱液的棉花吸收处理多余的氨
 CaCl2 + 2H2O + 2NH3↑
B . 氨的密度比空气小,因此用向下排空气法收集
C . 用湿润的红色石蕊试纸检验反应产生的气体
D . 用蘸有碱液的棉花吸收处理多余的氨
CaCl2 + 2H2O + 2NH3↑
B . 氨的密度比空气小,因此用向下排空气法收集
C . 用湿润的红色石蕊试纸检验反应产生的气体
D . 用蘸有碱液的棉花吸收处理多余的氨
短周期元素X、Y、Z、M的原子序数依次增大,且四种元素位于不同主族。X原子的最外层电子数比内层电子数多3个。Z、M位于同一周期,在该周期内Z的原子半径最大,M的原子半径最小。Y和Z形成的两种离子化合物中阴、阳离子的数目之比都为1:2。回答下列问题:
-
(1) X、Z两种元素形成的简单离子的半径大小关系是(用化学符号回答)。
-
(2) X和Z两种元素可以形成离子化合物P(Z3X)和Q(ZX3),化合物P与盐酸反应可生成两种盐,这两种盐的化学式是NaCl和;化合物Q中
 离子的每个X原子均达8电子稳定结构,其结构类似,则X3的电
离子的每个X原子均达8电子稳定结构,其结构类似,则X3的电 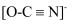 ,则
,则  的电子式是。
的电子式是。
-
(3) Y、Z、M三种元素形成的一种化合物是漂白液的主要成分。向该物质的水溶液中通入过量的CO2气体可以增强其漂白作用,则发生化学反应的离子方程式为。
-
(4) 实验室制备X的最简单氢化物的化学方程式为。
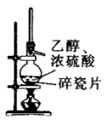
用下列仪器或装置进行相应实验,达不到实验目的的是( )
| 熔融 | 检验溴乙烷消去产物中的乙烯 | 制取并收集少量 | 探究温度对平衡移动的影响 |
| | | | |
| A | B | C | D |
A . A
B . B
C . C
D . D
利用下列装置进行实验,不能达到实验目的的是( )
| A | B | C | D |
| | | | |
| 制取 | 验证 | 制取少量 | 检验该条件下铁发生了吸氧腐蚀 |
A . A
B . B
C . C
D . D
下列实验操作或装置正确的是( )
| | | | |
| ① | ② | ③ | ④ |
A . 利用①所示装置证明了乙炔能使溴水褪色
B . 利用②所示装置制取乙烯
C . 利用③所示装置可以比较  、
、  、S的氧化性
D . 利用④所示装置制取并收集干燥纯净的
、S的氧化性
D . 利用④所示装置制取并收集干燥纯净的 
 、
、  、S的氧化性
D . 利用④所示装置制取并收集干燥纯净的
、S的氧化性
D . 利用④所示装置制取并收集干燥纯净的 
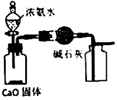
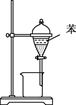
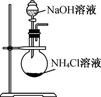
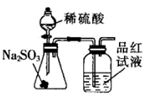
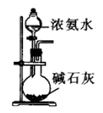
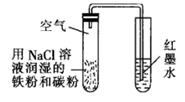
NaOH是一种常用的试剂。下列实验能达到实验目的的是( )
| A | B | C | D |
| 配制0.10mol/L 250mLNaOH溶液 | 用NaOH溶液除去苯中的苯酚 | 除去Cl2中的HCl | 实验室制取NH3 |
| | | | |
A . A
B . B
C . C
D . D
最近更新
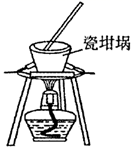
 固体
固体

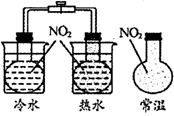

 具有漂白性
具有漂白性