氨的实验室制法 知识点题库
-
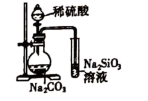
(1) 纯碱是一种重要的化工原料.目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺.
①“氨碱法”产生大量CaCl2副产品,该工艺中生成CaCl2的化学反应方程式为
②“联合制碱法”中相关的化学反应方程式为
③C02是制碱工业的重要原料,请阐述“联合制碱法”与“氨碱法”中C02的来源有何不同
-
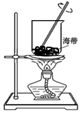
(2) 铀(U)是核反应最重要的燃料,在核反应中有重要的应用.目前已经研制成功一种螫合型离子交换树脂,它专门吸附海水中的U4+ , 而不吸附其他元素,其反应原理为 (用离子方程式表示,树脂用HR代替,下同),发生离子交换后的离子交换膜用酸处理还可再生,并得到含铀的溶液,其反应原理为
-
(3) 钢铁工业对促进经济和社会发展起了重要作用.
①不锈钢中含有的铬元素是在炼钢过程的氧吹 (填“前”或“后”)加入.
②炼钢时,加入硅、锰和铝的目的是 .
③炼铁和炼钢生产中,尾气均含有的主要污染物是 ;从环保和经济角度考虑,上述尾气经处理可用作
 2NH3 , 用烧碱进行干燥
C . 加热浓氨水,气体用碱石灰干燥
D . 加热NH4HCO3 , 气体用P2O5干燥
2NH3 , 用烧碱进行干燥
C . 加热浓氨水,气体用碱石灰干燥
D . 加热NH4HCO3 , 气体用P2O5干燥
 NCl3+3NH4Cl.某校化学兴趣小组同学设计了如图所示的实验装置(NH4Cl的分解温度为300℃左右).
NCl3+3NH4Cl.某校化学兴趣小组同学设计了如图所示的实验装置(NH4Cl的分解温度为300℃左右). 回答下列问题:

-
(1) 写出装置F中的烧瓶内发生反应的离子方程式:.写出A装置中的试管内发生的反应的化学方程式:
-
(2) E中的试剂为;B中的试剂为
-
(3) 导管G末端应连接的装置为图中的(填选项字母).

-
(4) NCl3遇水可发生水解反应生成两种物质,其中一种是可使湿润的红色石蕊试纸变蓝的气体,另一种有强氧化性,可使有色物质褪色.写出NCl3水解的化学方程式:.
-
(5) 已知C中生成的NH4Cl溶解在NCl3中,欲将二者分离可采取的操作方法为.
-
(1) NH3的电子式为.
-
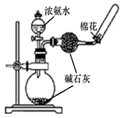
(2) 实验室中制取氨气的化学方程式为,生成的气体可以用蘸有浓盐酸的玻璃棒来检验,将产物溶于水,溶液呈酸性,用离子方程式表示原因;溶液中离子浓度由大到小的顺序为.
-
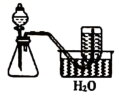
(3) 欲快速制取氨气,可将浓氨水滴入固体氢氧化钠中,其装置如图,请结合化学用语从化学平衡的角度解释:.
-
(4) 将SO2气体通入氯化钡溶液,未见有沉淀生成,继续通入NH3 , 则出现白色沉淀,请写出反应的离子方程式;若将SO2气体通入酸化的硝酸钡溶液,也产生白色沉淀,用离子方程式加以说明
-
(5) 氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
肼﹣﹣空气燃料电池是一种碱性电池,该电池放电时,负极的反应式.
-
(6) 氮氧化物的排放会对空气造成污染,利用氧化法除去烟气中的氮氧化物.
首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙.
已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3.
写出氧化吸收法除去氮氧化物的化学方程式.
-
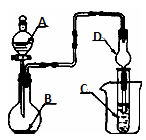
(1) Ⅰ.实验室制备NH2COONH4
反应原理:2NH3(g)+CO2(g)=NH2COONH4(s) ΔH<0。

装置A中发生的化学反应方程式为。
-
(2) 上述装置的连接顺序为A→→→;D装置所盛放的试剂为,C中三角漏斗的作用是。
-
(3) Ⅱ.制备实验的改进
有人提出利用下列装置代替聚氯乙烯薄膜反应器。
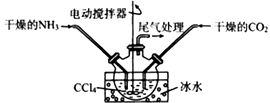
该装置的优点是、。结合化学反应方程式解释不能用水代替CCl4的原因是;当大量固体物质悬浮于CCl4上时即可停止反应,分离出产品的方法是。
-
(4) Ⅲ.对NH2COONH4产物成分的探究
已知,制备过程中因温度控制不当,在150℃时会产生尿素。如果对参加反应的气体干燥不彻底可能会有NH4HCO3、(NH4)2CO3杂质生成。
①请设计简单实验方案探究上述产物中是否有尿素。
②请设计定量实验方案探究上述产物(假设不存在NH4HCO3)中是否有碳酸铵。
(以上方案均不需详细描述实验步骤,限用试剂:蒸馏水、Ba(OH)2溶液;仪器自选)
图1  图2
图2  图3
图3 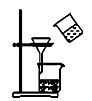 图4
图4 
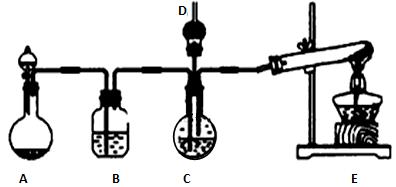
-
(1) A中制备气体时,所需药品是(选填字母序号)。
-
(2) B中盛有饱和碳酸氢钠溶液,其作用是。
-
(3) 写出制取氨气的化学方程式:。
-
(4) 在实验过程中,向C中通入气体有先后顺序,先通入气体的化学式是:。
-
(5) 检验D出口处是否有氨气逸出的方法是。
-
(6) 写出制纳米级碳酸钙的化学方程式:。
| A | B | C | D |
| | | | |
| 分离碘的四氯化碳溶液中的碘和四氯化碳 | 实验室制氨气 | 排水集气法收集NO | 除去NO气体中的NO2 |
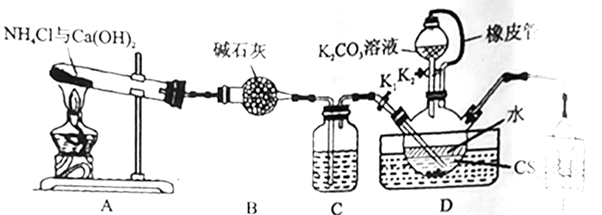
已知:①NH3不溶于CS2;
②在水溶液中,NH4HS、(NH4)2CO3受热易分解,NH4SCN在高于170℃时易分解;
③D中缓慢反应:CS2+3NH3  NH4HS+NH4SCN。
NH4HS+NH4SCN。
回答下列问题:
-
(1) 实验前应进行的操作是。实验中通过观察C中气泡速率,便于控制加热温度,装置C中的试剂最好选择(填标号)。
a.CS2 b.H2O c.浓硫酸
-
(2) 制备KSCN溶液:熄灭A处的酒精灯,关闭K1 , 使三颈烧瓶内液温在一段时间内维持在105℃,然后打开K2 , 继续保持液温105℃,缓缓滴入适量的K2CO3溶液。
①先加热一段时间,然后打开K2的目的是。
②写出装置D中生成KSCN的化学方程式:。
-
(3) 制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩、、、洗涤、干燥,得到硫氰化钾晶体。
-
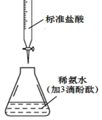
(4) 测定晶体中KSCN的含量:称取10.0g样品配成100mL溶液,再量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液,用0.1000mol/LAgNO3标准溶液滴定,重复2次滴定操作,滴定终点时消耗AgNO3标准溶液的体积如下表。已知:SCN-+Ag+=AgSCN↓(白色)
待测液的体积/mL
AgNO3标准溶液的体积/mL
第1次滴定
20.00
18.05
第2次滴定
20.00
20.10
第3次滴定
20.00
17.95
①将样品配成溶液时需用到的璃仪器有玻璃棒、烧杯、量筒、胶头滴管、。
②晶体中KSCN的质量分数为。
| | | | |
| A.验证稀硝酸的还原产物为NO | B.灼烧海带 | C.制取并收集NH3 | D.用滴定法测氨水的物质的量浓度 |
 )是一种良好的耐磨材料。实验室可用无水氯化铬(
)是一种良好的耐磨材料。实验室可用无水氯化铬(  )与氨气在高温下反应制备,反应原理为:
)与氨气在高温下反应制备,反应原理为:  。
。 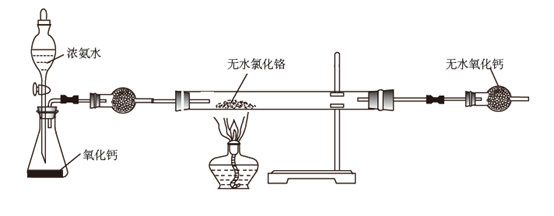
下列说法正确的是( )
 )脱水得到
B . 反应开始时应先将硬质玻璃管预热,再打开分液漏斗活塞
C . 硬质玻璃管右端的导气管过细,易产生堵塞
D . 将12.8g产品在空气中充分加热,得15.2g固体残渣(
)脱水得到
B . 反应开始时应先将硬质玻璃管预热,再打开分液漏斗活塞
C . 硬质玻璃管右端的导气管过细,易产生堵塞
D . 将12.8g产品在空气中充分加热,得15.2g固体残渣(  ),产品中可能含有
),产品中可能含有 
| A | B | C | D |
| | | | |
| 验证非金属性S>C>Si | 混合浓硫酸和乙醇 | 制备收集 | 实验室制少量氨气 |
 与
与  反应生成无毒物质。某同学采用以下装置和步骤模拟工业上氮氧化物的处理过程。
反应生成无毒物质。某同学采用以下装置和步骤模拟工业上氮氧化物的处理过程。 I.提供的装置
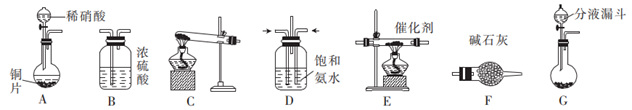
Ⅱ.  的制取
的制取
-
(1) 下列有关实验室制备氨气的说法正确的有(填序号)。
①用氮气与氢气反应制取氨气
②用排饱和食盐水的方法收集氨气
③实验室制氨气有时需要加热,有时不需要加热
④用无水氯化钙干燥氨气
-
(2) 若选择装置G制取氨气,则分液漏斗中盛装的液体试剂是。
-
(3) 若选择装置C制取氨气,则反应的化学方程式是。
-
(4) Ⅲ.模拟尾气的处理
选用上述部分装置,按下列顺序连接成模拟尾气处理装置,回答有关问题:
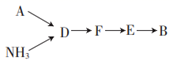
A装置中反应的离子方程式为。
-
(5) D装置中的液体可换成___________(填字母)。A .
 B .
B .  C . 浓硫酸
C . 浓硫酸
-
(6) 该同学所设计的模拟尾气处理实验存在的明显缺陷是。
-
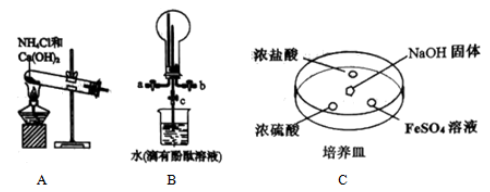
(1) 实验室用装置A制备氨气的化学方程式为。
-
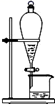
(2) 用装置B收集氨气时,进气口是(选填“a”或“b”)。打开装置B中的活塞c,烧瓶内产生了红色喷泉,则说明氨具有的性质是,。
-
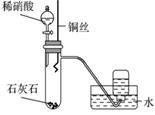
(3) 向C中
 固体上滴几滴浓氨水,迅速盖上玻璃片,浓盐酸液滴附近会出现白烟,发生反应的化学方程式为,检验白烟中阴离子的方法是。
固体上滴几滴浓氨水,迅速盖上玻璃片,浓盐酸液滴附近会出现白烟,发生反应的化学方程式为,检验白烟中阴离子的方法是。 液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应有
液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应有 和。
和。
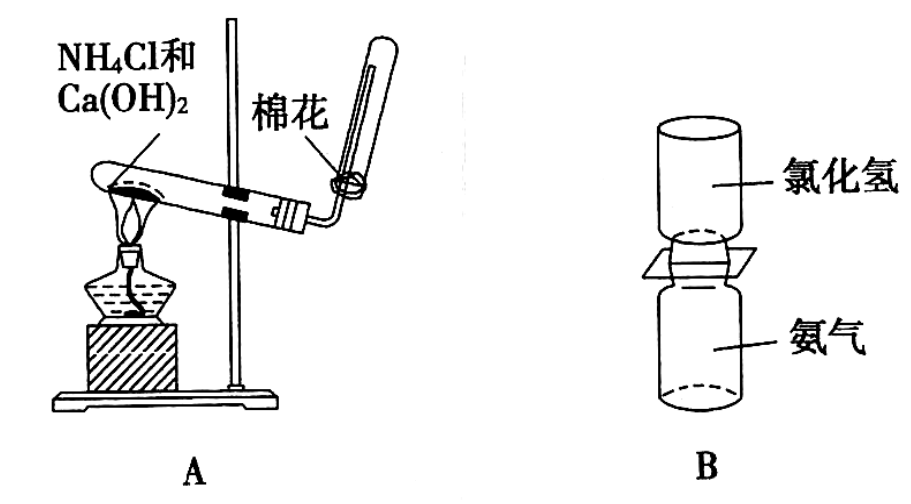
-
(1) A装置中制取氨气的化学方程式为;A装置收集氨气时采用向下排空气法,说明氨气的密度比空气的密度 (选填“大”或“小”)。
-
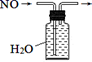
(2) B装置中的两个集气瓶中分别装有氯化氢气体和氨气,当抽去中间的玻璃片时,可观察到的实验现象是。
-
(3) 下图装置是研究Cl2的性质。
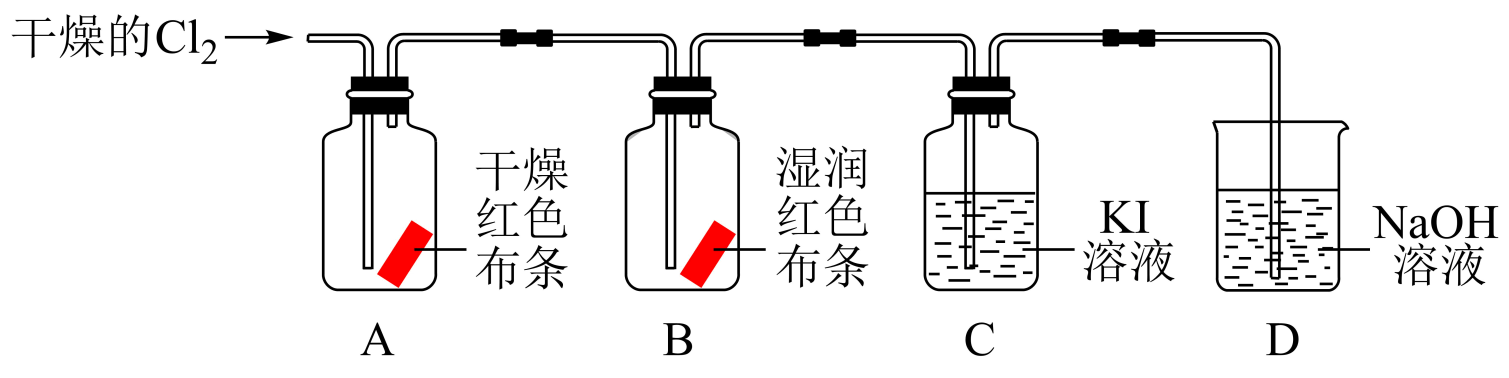
①观察到B中的现象是 。
②C中反应后的溶液遇淀粉变蓝,说明Cl2与KI溶液反应生成的物质有。
③D中NaOH溶液的作用是。
④A、B中现象不同,其原因是。
 检验无水乙醇中是否有水
B .
检验无水乙醇中是否有水
B . 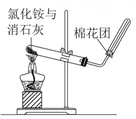 制取氨气
C .
制取氨气
C .  制取乙酸乙酯
D .
制取乙酸乙酯
D .  分馏石油
分馏石油