含硫物质的性质及综合应用 知识点题库
-
(1) SO2和Cl2均可作漂白剂,但将它们按物质的量1:1通入水中,却没有漂白性,原因是 (写出反应的离子方程式).
-
(2) 工业上常用电解法制Cl2 , 写出反应的化学方程式
-
(3) 某同学将足量的SO2通入一支装有氯化钡溶液的试管中,未见沉淀生成.向该试管中加入足量 (填字母),便能产生沉淀.
A.氨水 B.稀盐酸 C.硝酸钾溶液 D.氯水
-
(4) 将22.4L(标准状况)的SO2气体通入1L1mol•L﹣1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序是
-
(5) 在25℃时,向0.1L 0.002mol•L﹣1的NaCl溶液中逐滴加入0.1L 0.002mol•L﹣1硝酸银溶液,有白色沉淀生成,向反应后的浊液中继续加入0.1L 0.002mol•L﹣1的NaI溶液,看到的现象是 ,产生该现象的原因是 (用离子方程式表示). (已知:25℃时Ksp(AgCl)=1.6×10﹣10 , Ksp(AgI)=1.5×10﹣16 )
-
(1) 从物质分类的角度可以推测物质的性质.
①已知蛇纹石由MgO、Al2O3、SiO2、Fe2O3组成.已知Al2O3为两性氧化物,其中SiO2属于氧化物,MgO和Fe2O3属于氧化物(填“酸性”、“碱性”或“两性”).
②现取一份蛇纹石试样进行实验:
Ⅰ.先将其溶于过量的盐酸中、过滤,滤渣的主要成分是(填化学式).
II.再向滤液中加入NaOH溶液至沉淀的量最大、过滤,滤渣中的主要成分是(填化学式).
-
(2) 从化合价的角度可以预测物质的性质.
①SO2的性质(填序号,下同).
A.只有氧化性B.只有还原性C.既有氧化性又有还原性
②将SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色.反应结束后,硫元素存在形式合理的是
A.S2﹣B.SC.SO32﹣D.SO42﹣
-
(3) SO2与水反应生成的亚硫酸(H2SO3)具有中等强度酸性,二氧化碳的水溶液酸性较弱,请写出下列溶液中通入二氧化硫气体发生反应的化学方程式.(不包括和水的反应)
①Na2CO3溶液
②Na2SO3溶液.
-
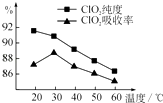
(1) 据图可知,反应时需要控制的适宜温度是℃,要达到此要求需要采取的措施是.
-
(2) 已知:黄铁矿中的硫元素在酸性条件下可被ClO3﹣氧化成SO42﹣ , 请写出制备二氧化氯(ClO2)的离子方程式:.
-
(3) 该校化学学习小组拟以“
 ”作为衡量ClO2产率的指标.若取NaClO3样品6.0g,通过反应和吸收获得400mL ClO2溶液,取此溶液20mL与37.00mL 0.500mol•L﹣1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.050 0mol•L﹣1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00mL.反应原理为:
”作为衡量ClO2产率的指标.若取NaClO3样品6.0g,通过反应和吸收获得400mL ClO2溶液,取此溶液20mL与37.00mL 0.500mol•L﹣1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.050 0mol•L﹣1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00mL.反应原理为: 4H++ClO2+5Fe2+═Cl﹣+5Fe3++2H2O
14H++Cr2O72﹣+6Fe2+═2Cr3++6Fe3++7H2O
试计算ClO2的“产率”(写出计算过程).
 NO2
NO2  HNO3
B . MnO2
HNO3
B . MnO2  Cl2
Cl2  漂白粉
C . 黄铁矿
漂白粉
C . 黄铁矿  SO2
SO2  SO3
SO3 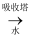 稀硫酸
D . 铝土矿
稀硫酸
D . 铝土矿 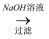 NaAlO2溶液
NaAlO2溶液  Al(OH)3
Al(OH)3  Al2O3
Al2O3  Al
Al
-
(1) FeCl3 具有净水作用,但会腐蚀设备,请回答下列问题:
①FeCl3净水的原理是。FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)。
②完成NaClO3 在酸性溶液中氧化FeCl2的离子方程式:
ClO3-+ Fe2++ = Cl-+ Fe3++
-
(2) 工业上从海带中提碘,常用硫酸酸化的MnO2氧化I— , 写出相关的离子方程式。
-
(3) 下列关系图中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是强酸。当X无论是强酸还是强碱时,都有如下转化关系:当X是强酸时,A、B、C、D、E均含有同一元素:当X是强碱时,A、B、C、D、E均含有另一种元素。回答下列问题:
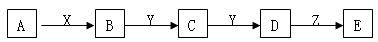
①当X是强酸时,写出B生成C的化学方程式。
②当X是强酸时,写出浓的E溶液与过量的B反应的化学方程式。
③当X是强碱时,简述检验B气体的操作方法和现象。
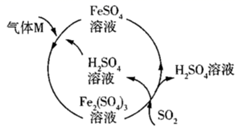
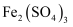 的
B . 气体M是
的
B . 气体M是  C . 气体M参加的反应不是氧化还原反应
D .
C . 气体M参加的反应不是氧化还原反应
D .  参加反应时氧化剂和还原剂的物质的量之比是1:1
参加反应时氧化剂和还原剂的物质的量之比是1:1
| 测定时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| pH | 4.9 | 4.7 | 4.5 | 4.4 | 4.4 | 4.4 |
下列有关说法错误的是( )
![]()
下列推断错误的是( )
 B . 若丙为
B . 若丙为  ,则X与稀盐酸反应可以得到丙
C . 若乙为
,则X与稀盐酸反应可以得到丙
C . 若乙为  ,则甲可能是
,则甲可能是  D . 若乙能使品红溶液褪色,则甲一定是S单质
D . 若乙能使品红溶液褪色,则甲一定是S单质
 Fe2O3+SO2↑+SO3↑,若将生成的气体通入BaCl2溶液中,得到的沉淀物质是( )
Fe2O3+SO2↑+SO3↑,若将生成的气体通入BaCl2溶液中,得到的沉淀物质是( )
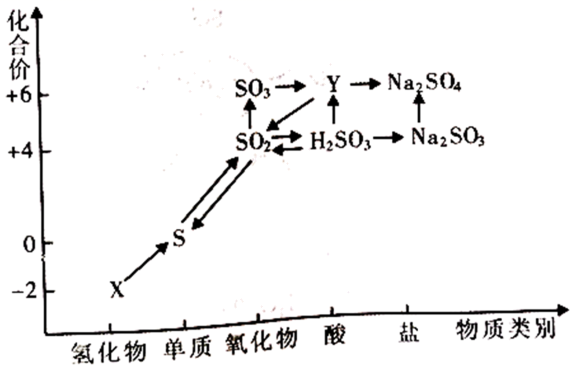
下列说法不正确的是( )
 和
和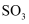 都属于酸性氧化物
C . 在加热情况下,y的浓溶液与铜单质可以发生化学反应生成
都属于酸性氧化物
C . 在加热情况下,y的浓溶液与铜单质可以发生化学反应生成 D . 24mL0.05
D . 24mL0.05 的
的 溶液与20mL0.02
溶液与20mL0.02 的
的 溶液恰好反应,已知
溶液恰好反应,已知 转化为
转化为 , 则Cr元素在还原产物中的化合价为+3
, 则Cr元素在还原产物中的化合价为+3
-
(1) Na2S2的结构与过氧化钠相似,则Na2S2的电子式为。
-
(2) 焦亚硫酸钠(Na2S2O5)是一种食品抗氧化剂,易溶于水。其中硫元素的化合价为价。
-
(3) 某小组同学设计实验实现几种价态硫元素的转化。可选用的实验药品如下:
a.Na2SO3溶液;b.浓硫酸;C.Na2S溶液;d稀硫酸;e.酸性KMnO4溶液;f.品红溶液;g.铜片。
实验序号
预期转化
选择试剂(填标号)
证明实现转化的现象
Ⅰ
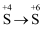
Ⅱ
a、c、d
淡黄色沉淀
Ⅲ
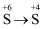
b、g、f
①实验Ⅰ选择的试剂是a和(填标号),该转化利用了Na2SO3的性。
②实验Ⅱ实现了+4价和-2价S向0价S的转化,写出该转化反应的离子方程式。
③实验Ⅲ中发生反应的化学方程式是,证明实现该转化的现象是。
①3S+ 6NaOH 2Na2S+ Na2SO3+ 3H2O
2Na2S+ Na2SO3+ 3H2O
②(x-1)S+Na2S Na2Sx (x=2~6)
Na2Sx (x=2~6)
③S+ Na2SO3 Na2S2O3
Na2S2O3
下列说法正确的是( )
 与
与 的化学反应是当前雾霾期间硫酸盐的主要生成路径。某实验小组对雾霾的成分进行了验证,并测定空气中
的化学反应是当前雾霾期间硫酸盐的主要生成路径。某实验小组对雾霾的成分进行了验证,并测定空气中 的含量及探究
的含量及探究 的部分性质。回答下列问题:
的部分性质。回答下列问题:
-
(1) 硫酸铵是某地PM2.5雾霾的主要成分,收集一定量的雾霾固体进行验证。取一定量的雾霾固体于试管中,加入适量的水溶解,把溶液分成两份盛于试管中:
操作步骤
实验现象
结论
①向其中一份
有白色沉淀生成
证明雾霾固体中含有

②向另一份中加,用镊子夹持湿润的红色石蕊试纸靠近试管口
③试管中有气泡产生,靠近试管口的红色石蕊试纸变蓝
证明雾霾固体中含有
 。综合上面实验,初步说明雾霾固体颗粒中含有
。综合上面实验,初步说明雾霾固体颗粒中含有
-
(2) 用如图所示简易装置测定空气中
 的含量。
的含量。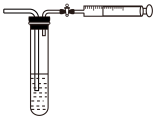
测定方法:在某监测点,量取
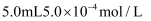 的碘溶液,注入图中的试管中,加几滴淀粉指示剂,此时溶液呈蓝色,按图中装置连接好仪器,利用止水夹控制,进行抽气,取下注射器排气,重复操作直到溶液的蓝色全部褪尽为止,共抽取空气8.0L,则测得该监测点空气中
的碘溶液,注入图中的试管中,加几滴淀粉指示剂,此时溶液呈蓝色,按图中装置连接好仪器,利用止水夹控制,进行抽气,取下注射器排气,重复操作直到溶液的蓝色全部褪尽为止,共抽取空气8.0L,则测得该监测点空气中 的含量为mg/L。
的含量为mg/L。 -
(3) 科学家们设计了双碱法处理
 , 该法能实现物料循环利用,请用化学方程式表示在
, 该法能实现物料循环利用,请用化学方程式表示在 溶液中加入CaO后的反应原理:。
溶液中加入CaO后的反应原理:。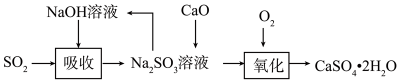
-
(4) 探究
 的部分性质。选用下面的装置和药品探究
的部分性质。选用下面的装置和药品探究 与HClO的酸性强弱。
与HClO的酸性强弱。
①甲同学认为按照A→C→F→尾气处理的顺序连接装置,可以证明
 与HClO的酸性强弱,乙同学认为该方案不合理,其理由是。
与HClO的酸性强弱,乙同学认为该方案不合理,其理由是。②丙同学采用间接法证明,实验方案为按照A→C→→→→(填字母)→尾气处理顺序连接装置,证明
 的酸性强于HClO的实验现象是。
的酸性强于HClO的实验现象是。



