含硫物质的性质及综合应用 知识点
二氧化硫:物理性质,无色、有刺激性气味的有毒气体、密度比空气大。易液化。SO2的化学性质,是酸性氧化物与碱性氧化物反应,漂白性,通入品红溶液后变为无色,漂白纸浆、毛、 丝、草编制品等。具有氧化性,能与硫化氢发生反应, 具有还原性与强氧化剂反应。 用途:制硫酸、制漂白剂、消毒剂和防腐剂。
硫酸:纯硫酸是一种无色黏稠油状、难挥发的液体,密度比水大。易溶于水,能以任意比与水混溶、溶解时大量放热。质量分数为98%的浓硫酸,密度为1.84g/cm3,物质的量浓度为18.4mol/L。具有脱水性、强氧化性和酸性。用途 :工业上用做制过磷酸钙、磷酸、硫酸铵等化肥。金属材料表面除锈、金属矿石的处理。制取挥发性酸,制取硫酸盐。精炼石油、制炸药、农药、医药、染料等。实验室常用于制备氢气、氯化氢、二氧化硫、硫化氢等气体,做干燥剂、脱水剂、催化剂。
含硫物质的性质及综合应用 知识点题库
高温下,硫酸亚铁发生如下反应:2FeSO4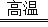 Fe2O3+SO2↑+SO3↑.若将生成的气体通入氯化钡溶液中,得到的沉淀物是( )
Fe2O3+SO2↑+SO3↑.若将生成的气体通入氯化钡溶液中,得到的沉淀物是( )
为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3 溶液,再分别滴加用如图所示的试剂对实验现象的“解释或结论”错误的是( )
选项 | 实验现象 | 解释或结论 |
A | a中溶液褪色 | 还原性:SO32﹣<I﹣ |
B | b中加硫酸后产生淡黄色沉淀 | SO32﹣和S2﹣在酸性条件下发生反应 |
C | c中滴入酚酞溶液变红,再加BaCl2溶液后产生白色沉淀且红色褪去 | SO32﹣+H2O⇌HSO3﹣+OH﹣ , 所以滴入酚酞变红; Ba2++SO32﹣→BaSO3↓(白),使水解平衡左移,红色褪去 |
D | d中产生白色沉淀 | Na2SO3溶液已被氧化变质 |

-
(1) Na2S溶液盛装在带橡胶塞的试剂瓶中,仔细闻有臭鸡蛋气味,请用离子方程式解释:,.
-
(2) 将Na2S溶液加入AlCl3溶液中,有白色沉淀和臭鸡蛋气味的气体生成,发生的离子反应为:.
-
(3) 将Na2S溶液加入AgCl的浊液中,生成的黑色沉淀是(写化学式).

-
(1) (实验探究)
将12.6g的Na2SO3与足量的浓硫酸反应可制得SO2的体积为L(标准状况),该制取SO2的反应(选填“是”或“不是”)氧化还原反应。
-
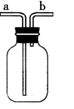
(2) 若用A装置检验SO2具有漂白性,则A中的溶液是。
若用A装置检验SO2是一种酸性氧化物,则A中的溶液是。
-
(3) D装置中发生的反应是(写化学方程式):。
-
(4) (实验讨论)
对如图中的C处,甲、乙两同学都选用如图装置,但对连接方式持有不同意见。甲同学认为:SO2气体应从a处通入集气瓶中。乙同学认为:SO2气体应从b处通入集气瓶中。你认为(填“甲”或“乙”)同学的看法是正确。
-
(5) (联系实际)
SO2对环境的影响较大,为了减少SO2对空气的污染,请你从工业生产的角度提出一种有效可行的措施(用文字表述):。
-
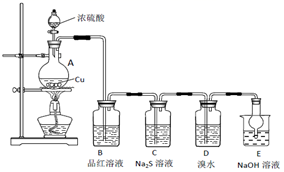
(1) A中发生反应的化学方程式为。
-
(2) B中的现象是。
-
(3) C中出现淡黄色沉淀,反应中Na2S做 (填“氧化剂”或“还原剂”)。
-
(4) D溴水褪色,该反应S元素的价态变化是由+4价变为价。
-
(5) 某同学认为D中换成H2O2溶液也可以实现上述硫元素的价态转化,并通过实验进一步证明了他的观点。实验方案和现象为:取D中反应后的溶液于试管中,。
-
(6) E的作用是,离子方程式为。
-
(7) 上述实验体现SO2 的性质有。
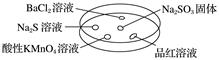
下表中对实验现象的描述或所做的解释错误的是( )
| 选项 | 实验现象 | 解释 |
| A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
| B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
| C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
| D | 品红溶液褪色 | SO2具有漂白性 |
 SO3
SO3  H2SO4
B . Cu2(OH)2CO3
H2SO4
B . Cu2(OH)2CO3  CuSO4(aq)
CuSO4(aq)  Cu
C . SiO2
Cu
C . SiO2  Si
Si  SiCl4
SiCl4  Si
D . Mg(OH)2
Si
D . Mg(OH)2  MgCl2(aq)
MgCl2(aq)  Mg
Mg
 在农药、制药行业中用途广泛。某化学研究性学习小组通过查阅资料,设计了如下图所示装置来制备
在农药、制药行业中用途广泛。某化学研究性学习小组通过查阅资料,设计了如下图所示装置来制备  。
。 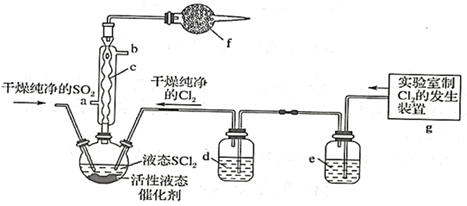
已知:①  是一种液态化合物,沸点为77℃
是一种液态化合物,沸点为77℃
②  遇水剧烈反应,液面上产生白雾,并有刺激性气味的气体产生
遇水剧烈反应,液面上产生白雾,并有刺激性气味的气体产生
③实验室合成  原理:
原理: 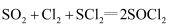
请回答以下问题:
-
(1) 仪器c的名称是,f中的最佳试剂是(填字母符号)。
A.碱石灰 B.浓硫酸 C.
 溶液 D.无水氯化钙
溶液 D.无水氯化钙 -
(2) 实验室用浓盐酸与
 粉末反应制
粉末反应制  的化学方程式为。
的化学方程式为。
-
(3)
 与水反应的化学方程式为。
与水反应的化学方程式为。
-
(4) 下列三种制备
 的方案中最佳选择是.
的方案中最佳选择是. 方案
甲
乙
丙
发生装置
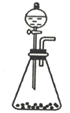
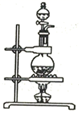
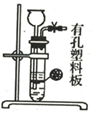
所选试剂
 和
和  粉末
粉末 铜片
铜片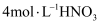 和
和  粉末
粉末 -
(5) 装置g中产生的
 经过e、d后进入三颈烧瓶,e中的试剂为。
经过e、d后进入三颈烧瓶,e中的试剂为。
-
(6) 实验结束后,将三颈烧瓶中混合物分离开的实验操作是(已知
 的沸点为50℃);若反应中消耗
的沸点为50℃);若反应中消耗  的体积为
的体积为 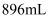 (已转化为标准状况,
(已转化为标准状况,  足量),最后得到
足量),最后得到  ,则
,则  的产率为(已知产率=
的产率为(已知产率=  ×100%)。
×100%)。


 和空气的混合气体通入
和空气的混合气体通入 、
、 和
和 的混合溶液中回收
的混合溶液中回收 , 其转化如下图所示(
, 其转化如下图所示( 不溶于水)。下列说法中,错误的是( )
不溶于水)。下列说法中,错误的是( )
 的反应为
的反应为 B . 过程②中,
B . 过程②中, 作氧化剂
C . 过程③中,各元素化合价均未改变
D . 回收S的总反应为
作氧化剂
C . 过程③中,各元素化合价均未改变
D . 回收S的总反应为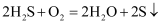
 通入品红溶液中,待溶液褪色后,加热,溶液恢复原色,说明
通入品红溶液中,待溶液褪色后,加热,溶液恢复原色,说明 的漂白是可逆的
的漂白是可逆的
 B .
B . 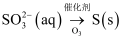 C . 稀
C . 稀 D .
D . 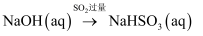

已知:催化氧化阶段的反应是可逆反应。下列说法错误的是( )
 D . 生成
D . 生成 , 上述流程放出的总热量为
, 上述流程放出的总热量为

-
(1) 雾霾中含有多种物质,其中属于盐类是(填写名称);图中的电解质有种。
-
(2)
 在水中的电离方程式是:;把稀硫酸滴入氢氧化钡溶液中,反应的离子方程式是。
在水中的电离方程式是:;把稀硫酸滴入氢氧化钡溶液中,反应的离子方程式是。
-
(3) 下列物质属于电解质的是____(填字母)。A .
 B .
B .  C .
C .  D .
D . 
-
(4) 某白色固体中含有
 、
、 、
、 , 若只取用一次样品,在同一个容器中检验出3种阴离子,所用的试剂及顺序是。
, 若只取用一次样品,在同一个容器中检验出3种阴离子,所用的试剂及顺序是。



