含硫物质的性质及综合应用 知识点题库
下列关于物质性质的叙述中,正确的是( )
A . Cl2不但能与金属活动顺序表氢以前的金属反应,也能与金属活动顺序表氢以后的金属反应
B . N2是大气中的主要成分之一,雷雨时,可直接转化为NO2
C . 硫是一种淡黄色的能溶于水的晶体,既有氧化性又有还原性
D . 硅是应用广泛的半导体材料,常温下只与氟气、氢氟酸反应
下列说法不正确的是( )
A . 熟石灰与水混合成糊状后会很快凝固,转化为坚硬的生石膏,可用它制作石膏绷带
B . 人造纤维是利用自然界的非纤维材料通过化学合成方法得到的
C . 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理
D . 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染”
下列化合物不能由单质直接化合生成的是( )
A . SO3
B . FeS
C . Cu2S
D . CuCl2
以化合价为纵坐标,以物质的类别为横坐标所绘制的图象叫价类图.如图为硫的价类图,例如d点可表示+6价的硫酸盐.下列说法错误的是( )
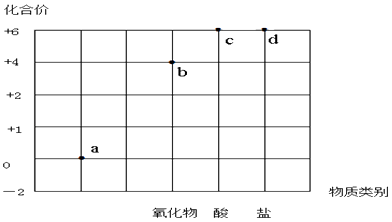
A . a点表示的物质所属的物质类别是单质
B . b点表示的物质可以是SO2或SO3
C . c点表示的化合物的浓溶液可作为干燥剂
D . d点表示的可溶性物质能与BaCl2溶液发生反应
下列物质转化在给定条件下能实现的是( )
①S  SO2
SO2 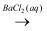 BaSO4
BaSO4
②CuSO4(aq) 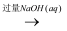 Cu(OH)2悬浊液
Cu(OH)2悬浊液 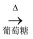 Cu2O
Cu2O
③饱和NaCl(aq)  NaHCO3
NaHCO3  Na2CO3
Na2CO3
④Fe2O3  FeCl3(aq)
FeCl3(aq)  无水FeCl3 .
无水FeCl3 .
A . ①③
B . ②③
C . ②④
D . ①④
SO2、NO是大气污染物.吸收SO2 和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
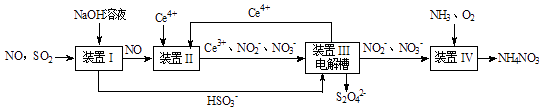
-
(1) 装置Ⅰ中生成HSO3﹣的离子方程式为.
-
(2) 含硫各微粒(H2SO3、HSO3﹣和SO32﹣)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图1所示.

①下列说法正确的是(填字母序号).
a.pH=8时,溶液中c(HSO3﹣)<c(SO32﹣)
b.pH=7时,溶液中c(Na+)=c(HSO3﹣)+c(SO32﹣)
c.为获得尽可能纯的NaHSO3 , 可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:.
-
(3) 装置Ⅱ中酸性条件下NO被Ce4+氧化的产物主要是NO3﹣、NO2﹣ , 写出生成NO3﹣时的离子方程式.
-
(4) 装置Ⅲ的作用之一是再生Ce4+ , 同时获得副产品Na2S2O4 , 其原理如图2所示.

①阴极的电极反应式为.
②生成Ce4+从电解槽的(填字母序号)口流出.
-
(5) 从氧化池Ⅳ中得到的粗产品NH4NO3的实验操作是,过滤、洗涤等.标况下,若V L尾气(设气体体积分数:NO为a%、SO2为b%、CO2为c%)经上述流程变化后最终获得m g NH4NO3 , 则尾气中NO的利用率为.
在给定条件下,下列所示的物质间的转化均能实现的是( )
A . SiO2  Na2SiO3(aq)
Na2SiO3(aq)  H2SiO3
B . MgCl2·6H2O
H2SiO3
B . MgCl2·6H2O  MgCl2
MgCl2  Mg
C . SO2
Mg
C . SO2  CaSO3
CaSO3  CaSO4
D . Fe
CaSO4
D . Fe  Fe2O3
Fe2O3  FeCl3(aq)
FeCl3(aq)
 Na2SiO3(aq)
Na2SiO3(aq)  H2SiO3
B . MgCl2·6H2O
H2SiO3
B . MgCl2·6H2O  MgCl2
MgCl2  Mg
C . SO2
Mg
C . SO2  CaSO3
CaSO3  CaSO4
D . Fe
CaSO4
D . Fe  Fe2O3
Fe2O3  FeCl3(aq)
FeCl3(aq)
含硫的物质与人们的生活密切相关。已知硫元素常见的化合价有-1、0、+4、+6四种,其不同价态的物质间可相互转化。完成下列填空:
-
(1) 硫离子的结构示意图。
-
(2) 黑火药爆炸时,发生的反应之一为:S+2KNO3+3C
 K2S+3CO2↑+N2↑该反应中1mol S能氧化Cmol。
K2S+3CO2↑+N2↑该反应中1mol S能氧化Cmol。
-
(3) 将硫化氢气体与二氧化硫气体在集气瓶中混合发生反应,现象。二氧化硫呈现(选填“氧化性”、“还原性”)。
-
(4) 二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。
以下是二氧化硫形成酸雨的两种途径:
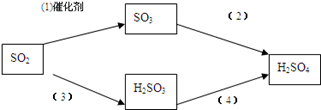
请分别写出(1)和(4)的化学方程式: , 。
-
(5) 你认为减少酸雨产生的途径可采用的措施是_______________。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A . ①②③ B . ②③④ C . ①③⑤ D . ①③④⑤ -
(6) 硫酸盐的种类很多,且应用广泛,医疗上常用(写化学式)作X射线透视肠胃的内服药剂,生活用水可以用(写化学式)作净水剂。
-
(7) 有化学反应2SO2(g)+O2(g)
 2SO3(g) △H=-190kJ/mol,450℃往2L密闭容器中充入2mol SO2和1mol O2 , 5分钟后的SO2物质的量为0.5mol,则在5min内,用消耗的O2表示的反应速率为。在其它条件不变时,扩大容器体积,v(正)(选填“增大”或“减小”或“不变”),v(逆)(选填“增大”或“减小”或“不变”)。
2SO3(g) △H=-190kJ/mol,450℃往2L密闭容器中充入2mol SO2和1mol O2 , 5分钟后的SO2物质的量为0.5mol,则在5min内,用消耗的O2表示的反应速率为。在其它条件不变时,扩大容器体积,v(正)(选填“增大”或“减小”或“不变”),v(逆)(选填“增大”或“减小”或“不变”)。
下列解释事实的方程式正确的是( )
A . 用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:Na2S2O3+2H+=SO2↑+S↓+2Na++H2O
B . 氢氧化亚铁暴露于空气中会变色:4Fe(OH)2+O2+2H2O=4Fe(OH)3
C . 向Ca(ClO)2溶液中通入过量CO2制取次氯酸: Ca2++ClO-+H2O+CO2=2HClO+CaCO3↓
D . 氯气用于自来水消毒:Cl2 + H2O  2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
在给定条件下,下列选项中所示的物质间转化均能实现的是( )
A . SiO2  H2SiO3
H2SiO3  Na2SiO3
B . S
Na2SiO3
B . S  SO2
SO2  BaSO3
C . CuSO4
BaSO3
C . CuSO4  Cu(OH)2
Cu(OH)2  Cu2O
D . 饱和NaCl溶液
Cu2O
D . 饱和NaCl溶液  NaHCO3
NaHCO3  Na2CO3
Na2CO3
 H2SiO3
H2SiO3  Na2SiO3
B . S
Na2SiO3
B . S  SO2
SO2  BaSO3
C . CuSO4
BaSO3
C . CuSO4  Cu(OH)2
Cu(OH)2  Cu2O
D . 饱和NaCl溶液
Cu2O
D . 饱和NaCl溶液  NaHCO3
NaHCO3  Na2CO3
Na2CO3
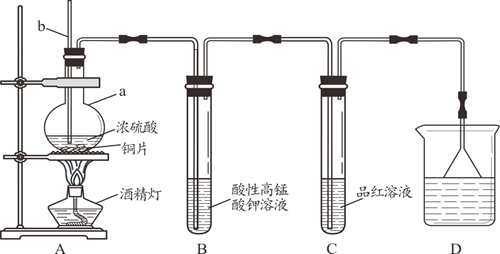
某化学兴趣小组设计如下图所示的实验装置,探究SO2的性质。[部分夹持仪器已略去]
-
(1) [实验探究]
装置A中反应的化学方程式是,仪器a的名称是,导管b的作用是。
-
(2) 实验一段时间后,装置B中观察到现象是。
-
(3) 装置C中溶液褪色说明SO2具有性。
-
(4) 装置D烧杯中盛放的试剂是(填“氢氧化钠溶液”或“浓硫酸”)。
-
(5) 实验结束时需从导管b通入大量空气,其目的是。
-
(6) 用12.8g铜与足量浓硫酸反应,理论上最多可生成LSO2气体(标准状况下)。
-
(7) [知识拓展]
酸雨造成的危害是:(举一例)。
-
(8) 探究SO2形成硫酸型酸雨的途径:将SO2通水入中,测得所得溶液的pH7(填“>”“=”或“<”)。然后每隔1h测定其pH,发现pH逐渐变小,直至恒定,其原因)是(用化学方程式表示)。
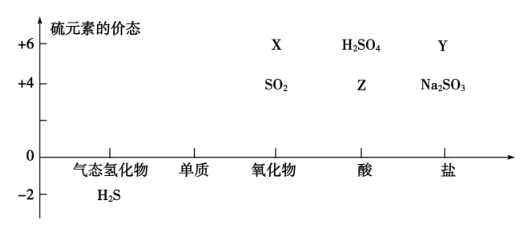
如图的坐标系是部分含硫化合物的转化关系图。
-
(1) X的名称为,Z的化学式为。
-
(2) 用图中物质之间的反应,证明SO2有氧化性的反应的化学方程式为。
-
(3) 若X能与Na2O2的反应生成Y,则该反应的化学方程式为。
-
(4) 已知:
 +I2+H2O=
+I2+H2O=  +2I-+2H+。某溶液中可能含有大量的Na+、
+2I-+2H+。某溶液中可能含有大量的Na+、  、Fe2+、K+、I-、
、Fe2+、K+、I-、  、
、  。向该溶液中滴加少量溴水,溶液仍呈无色,依此可判断该溶液中肯定含有;肯定不能含有。
。向该溶液中滴加少量溴水,溶液仍呈无色,依此可判断该溶液中肯定含有;肯定不能含有。
-
(5) 向50mL浓硫酸中加入铜片,加热,反应一段时间,共收集到2.24L(标准状况)的SO2 , 将反应后的混合物加水稀释,再加入足量锌粉放出15.68L(标准状况)的H2 , 则原浓硫酸的物质的量浓度为,整个过程消耗锌粉的质量为。
下列化合物中,能用相应的单质直接化合得到的是( )
①CuS②FeS③HCl④SO2⑤SO3⑥FeCl2⑦CuCl2
A . 全部
B . 仅①②③④⑦
C . 仅②④⑤⑦
D . 仅②③④⑦
将下列气体通入溶有足量  的
的  溶液中,没有沉淀产生的是( )
溶液中,没有沉淀产生的是( )
 的
的  溶液中,没有沉淀产生的是( )
溶液中,没有沉淀产生的是( )
A .  B . HCl
C .
B . HCl
C .  D .
D . 
 B . HCl
C .
B . HCl
C .  D .
D . 
下列关于硫的说法不正确的是( )
A . 游离态的硫存在于火山口附近或地壳的岩层里
B . 单质硫既有氧化性,又有还原性
C . 试管内壁附着的硫可用二硫化碳溶解除去
D . 硫与铁、铜反应,生成FeS、CuS
甲、乙、丙均为中学化学常见的物质,一定条件下它们有如下转化关系(部分反应产物已省略)。下列说法正确的是( )
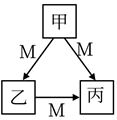
A . 若 M为 Fe,则甲可能为硝酸溶液
B . 若甲、乙、丙均为钠的化合物,则 M一定为稀盐酸
C . 若甲为 Al,则 M 可能为氢氧化钠
D . 若 M为 O2 , 则甲可能为 S单质
下列转化关系错误的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
在“价—类”二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。如图中的字母分别代表硫及其常见化合物,相关推断不合理的是( )
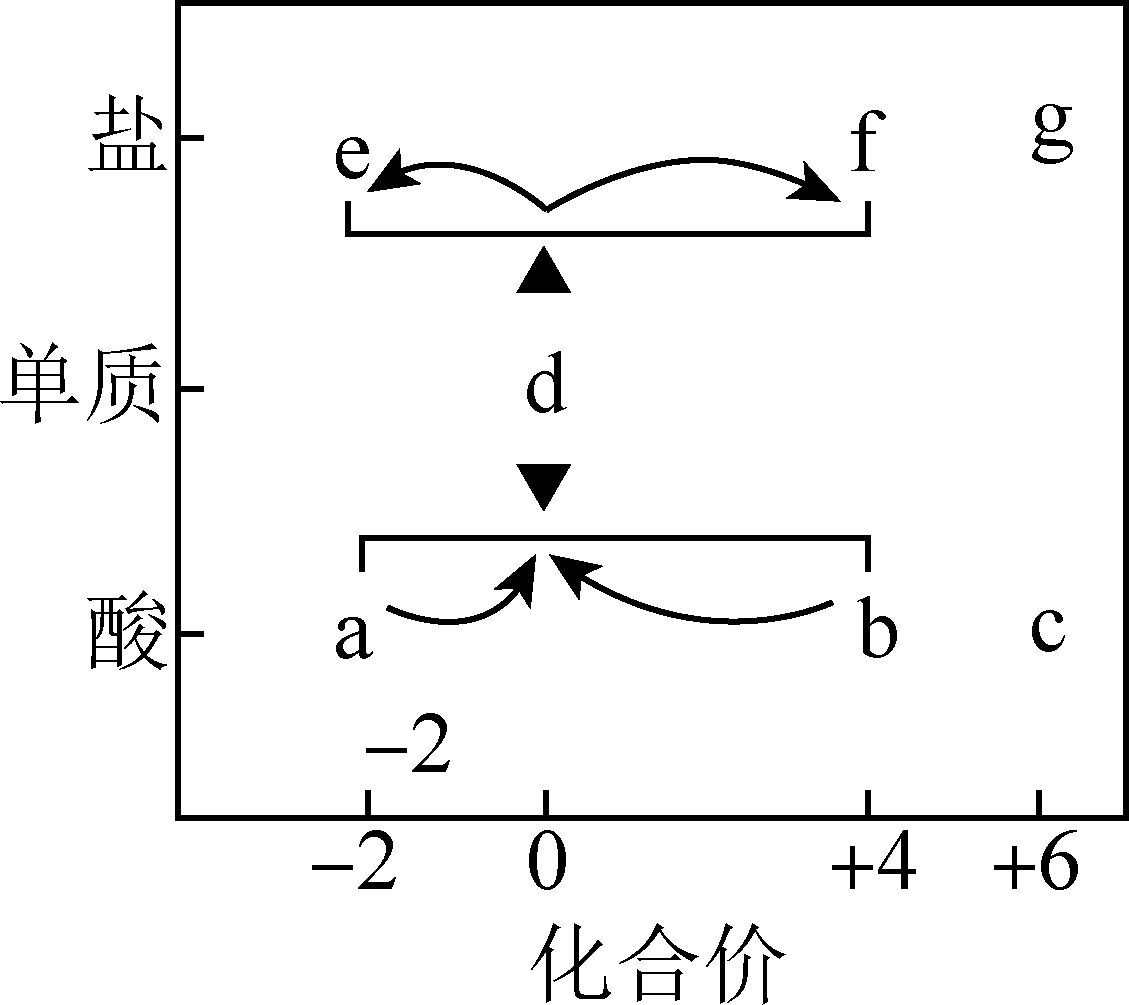
A . b既具有氧化性又具有还原性
B . 硫酸型酸雨的形成过程涉及b到c的转化
C . a溶液与b溶液反应过程中有淡黄色沉淀生成
D . d在加热下与强碱溶液反应生成e和f,且n(e):n(f)=1:2
已知某物质X能发生如下转化:

下列有关上述转化关系中物质及其反应的叙述正确的是( )
A . 若X为C,则Y可以和氢氧化钠反应生成盐和水
B . 若X为S,则A为硫酸
C . 反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
D . X一定是非金属单质或非金属氢化物
下列物质之间的转化不涉及氧化还原反应的是( )
A . 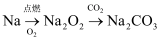 B .
B .  C .
C .  D .
D . 
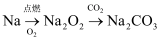 B .
B .  C .
C .  D .
D . 
最近更新



