元素周期表中原子结构与元素性质的递变规律 知识点
元素周期表中原子结构:是元素原子核外电子排布的特点,又可用原子结构示意图表示。元素性质:是指元素的金属性和非金属性。原子结构与元素性质的递变规律实质是原子结构的周期性排布导致的结构,元素的性质随着原子序数的递增呈现周期性的变化。
元素周期表中原子结构与元素性质的递变规律 知识点题库
下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).

把与下面的元素有关性质相符的曲线的标号填入相应括号中:
(1)ⅡA族元素的价电子数 .
(2)第三周期元素的最高化合价 .
(3)ⅠA族元素金属单质熔点 .
(4)第三周期离子Na+、Mg2+、Al3+、P3﹣、S2﹣、Cl﹣的离子半径 .
(5)第二、三周期元素随原子序数递增原子半径的变化
门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确.根据元素周期律,下列有关X的性质的描述中正确的是( )
A . X单质易与水反应
B . X形成的氧化物易与水反应生成酸
C . X易形成氧化物XO
D . XH4的稳定性比SiH4的低
已知W,X,Y,Z为短周期元素,W,Z同主族,X,Y,Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X,Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是( )
A . X,Y,Z,W的原子半径依次减小
B . W与X形成的化合物中只含离子键
C . W含氧酸的酸性一定比Z的含氧酸的酸性强
D . 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
X、Y、Z、W、R是短周期元素,原子序数依次增大.非金属X原子核外各层电子数之比为1:2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨.请回答下列问题:
-
(1) 元素X的最高价氧化物的电子式为;元素Z的离子结构示意图为.
-
(2) 单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为.
-
(3) 元素W位于周期表的第族,其非金属性比R弱,用原子结构的知识解释原因:.
-
(4) R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液作该氧化物的吸收剂,写出吸收剂与足量该氧化物反应的离子方程式:.
-
(5) Y和Z组成的化合物ZY,被大量用于制造电子元件.工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为.
有aXn+ 和bYm﹣两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是( )
A . b﹣a=n+m
B . a﹣b=n﹣m
C . 质子数Y>X
D . 核电荷数Y<X
短周期元素M,W,X,Y,Z的原子序数依次增大,M元素的一种核素没有中子,且M,W,X,Y+、Z的最外层电子数与其电子层数的比值依次为1、2、3、4、2(不考虑零族元素),下列关于这些元素的叙述正确的是
( )
A . X分别和其它四种元素均可形成至少2种化合物
B . M分别和W,X,Y,Z形成化合物,均显相同化合价
C . M,X,Z三种元素组成的化合物含有离子键
D . M,X,Y组成化合物和Y,Z组成化合物,它们所含的化学键类型完全相同
下列物质是中学化学常见的碱,在相同条件下,碱性最强的是( )
A . Ca(OH)2
B . Mg(OH)2
C . KOH
D . NaOH
a、b、c、d为原子序数依次增大的四种短周期主族元素.a的最外层电子数是内层电子数的3倍,b的M层上有1个电子,a与c同主族.下列说法不正确的是( )
A . 原子半径:b>c>d
B . 气态氢化物稳定性:a>c
C . 简单阴离子还原性:d>c
D . ab可形成既含离子键又含共价键的离子化合物
下表是元素周期表的一部分,回答相关的问题。
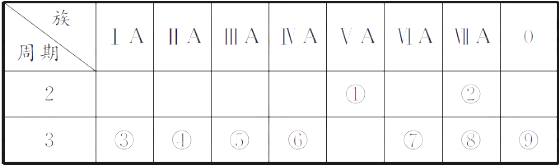
-
(1) 写出④的元素符号。
-
(2) 在这些元素中,最活泼的金属元素与水反应的离子方程式:。
-
(3) 在这些元素中,最高价氧化物的水化物酸性最强的是(填相应化学式,下同),碱性最强的是。
-
(4) 这些元素中(除⑨外),原子半径最小的是(填元素符号,下同),原子半径最大的是。
-
(5) ②的单质与③的最高价氧化物的水化物的溶液反应,其产物之一是OX2 , (O、X分别表示氧和②的元素符号,即OX2代表该化学式),该反应的离子方程式为(方程式中用具体元素符号表示)。
元素周期表中短周期元素W、X、Y、Z、M原子序数依次增大,W的某种简单离子只有质子;X元素原子的最外层电子数是内层电子数的3倍;元素Y在自然界中只能以化合态存在,其原子半径是同周期元素里原子半径最大的;Z元素离子半径在同周期中是最小的;W的单质在M的单质中燃烧伴有苍白色火焰。下列说法正确的是( )
A . 简单离子半径:M>Y>Z>X>W
B . 1molY的单质与足量的X单质完全反成,产物中离子总数定为1.5NA
C . Z的单质既能与Y的最高价氧化物对应的水化物发生反应放出气体,也能与M的最高价氧化物对应的水化物发生反应放出气体,且放出的气体体积都为33.6L(标况下)
D . W的单质与X、M的单质都能反应,且反应中W的单质都作氧化剂
两种元素能形成XY2型离子化合物,其原子序数依次为()
A . 6和8
B . 12和17
C . 13和8
D . 11和16
已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构,下列关于X、Y、Z、W四种元素的描述,错误的是( )
A . 原子半径:X>Y>Z>W
B . 原子序数:Y>X>Z>W
C . 原子最外层电子数:Z>W>Y>X
D . 金属性:X>Y,还原性:W2->Z-
钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
-
(1) 钴元素在周期表中的位置是,其外围电子排布式为。
-
(2) 已知第四电离能大小:I4(Fe)> I4 (Co),从原子结构的角度分析可能的原因是。
-
(3) 配位化学创始人维尔纳发现,取1mol配合物CoCl3·6NH3(黄色)溶于水,加人足量硝酸银溶液,产生3mol白色沉淀,沉淀不溶于稀硝酸。原配合物中络离子形状为正八面体。
①根据上述事实推测原配合物中络离子化学式为。
②该配合物在热NaOH溶液中发生反应,并释放出气体,该反应的化学方程式;生成气体分子的中心原子杂化方式为。
-
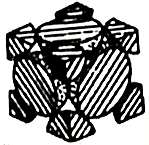
(4) 经X射线衍射测定发现,晶体钴在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于,若该堆积方式下的晶胞参数为acm,则钴原子的半径为pm。
短周期主族元素W,X,Y,Z的原子序数依次增大,W,X的最外层电子数之和与Z的最外层电子数相等, W,Y同主族。将W,X的气态单质在催化剂及一定温度和压强下发生可逆反应生成化合物R,反应关系如下表所示,下列说法正确的是( )
| 物质 | W的单质 | X的单质 | R |
| 起始时/mol | 0.3 | 0.3 | 0 |
| 平衡时/mol | 0.12 | 0.24 | 0.12 |
A . 离子半径:X> Y> Z
B . Y、Z两种元素形成的化合物的水溶液呈酸性
C . Y、Z分别与W形成的化合物,前者的沸点高
D . 四种元素分别与氧形成的化合物均只有两种
下列叙述能证明金属A的金属性比金属B强的是( )
A . A原子的最外层电子数比B原子的最外层电子数少
B . A原子的电子层数比B原子的电子层数多
C . 1molA从稀硫酸中置换的氢气比1molB置换的氢气多
D . 常温下,A能从冷水中置换出氢气,而B不能
下列叙述中,错误的是( )
A . 原子最外层电子数为2的元素一定处于周期表第ⅡA族
B . 第VⅡA族元素都是非金属元素
C . 室温时,0族元素的单质都是气体
D . 碱金属元素在自然界中都以化合态存在
元素X、Y、Z、Q、R的原子序数依次增大且小于20,其原子半径和最外层电子数之间的关系如图所示。下列判断正确的是( )
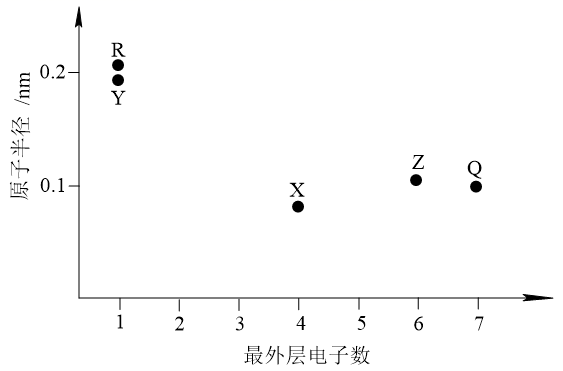
A . X的电负性比Q的大
B . Q的简单离子半径比R的大
C . Z的简单气态氢化物的热稳定性比Q的强
D . Y的最高价氧化物对应的水化物的碱性比R的强
X、Y、Z、W、M均为短周期元素,M的一种核素不含中子,X、Y、Z、W在周期表中的位置如图所示,Y原子最外层电子数为内层电子数的3倍。下列说法错误的是( )
X | Y | ||
Z | W |
A . X、Y均能与M形成10电子分子
B . 原子半径: C . 由X、Y、M形成的化合物水溶液一定呈酸性
D . 简单阴离子还原性:
C . 由X、Y、M形成的化合物水溶液一定呈酸性
D . 简单阴离子还原性:
 C . 由X、Y、M形成的化合物水溶液一定呈酸性
D . 简单阴离子还原性:
C . 由X、Y、M形成的化合物水溶液一定呈酸性
D . 简单阴离子还原性:
如表为元素周期表的一部分,请回答有关问题
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
-
(1) 已知元素⑩的一种核素,其中中子数为45,用原子符号表示该核素为。
-
(2) 由元素③形成的单质分子的结构式为,用电子式表示⑤和⑧两元素形成化合物的过程。
-
(3) 由上述元素构成的淡黄色固体化合物的电子式,该化合物所含的化学键类型(填“离子键”、“极性键”或“非极性键”)。
-
(4) 元素⑦、⑧、⑨其离子半径由大到小的顺序是(用离子符号),元素⑤的最高价氧化物的水化物与元素⑥的最高价氧化物对应的水化物反应的离子方程式为。
-
(5) 下列事实不能说明元素⑧的非金属性比元素⑦的非金属性强的是____。A.元素⑧的单质与⑦的氢化物的水溶液反应,溶液变浑浊A . 元素⑧的单质能将Fe氧化成三价铁,而元素⑦的单质只能将铁氧化成二价铁 B . ⑦和⑧两元素的简单氢化物受热分解,后者的分解温度高 C . 元素⑧的氢化物的水溶液的酸性比元素⑦的氢化物水溶液的酸性强
下面叙述正确的是( )
A . 氧族元素氢化物的沸点随原子序数的增大而增大
B . 离子半径大小: C . 第一主族元素都只有正价,无负价
D . P,S,Cl三种元素氧化物的水化物的酸性依次增强
C . 第一主族元素都只有正价,无负价
D . P,S,Cl三种元素氧化物的水化物的酸性依次增强
 C . 第一主族元素都只有正价,无负价
D . P,S,Cl三种元素氧化物的水化物的酸性依次增强
C . 第一主族元素都只有正价,无负价
D . P,S,Cl三种元素氧化物的水化物的酸性依次增强
最近更新



