离子键的形成 知识点题库
在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )
A . 将SO2通入水中
B . 火碱溶于水
C . 将HCl通入水中
D . 硫酸氢钠溶于水
下列说法正确的是( )
A . CaCl2中既有离子键又有共价键,所以CaCl2属于离子化合物
B . H2O汽化成水蒸气、分解为H2和O2 , 都需要破坏共价键
C . C4H10的两种同分异构体因为分子间作用力大小不同,因而沸点不同
D . 水晶和干冰都是共价化合物,均属于原子晶体
下列反应过程中,同时有离子键和共价键的断裂和形成的是( )
A . 2H2+O2  2H2O
B . NH3+HCl=NH4Cl
C . 2Na2O2+2H2O=4NaOH+O2↑
D . 2Mg+CO2
2H2O
B . NH3+HCl=NH4Cl
C . 2Na2O2+2H2O=4NaOH+O2↑
D . 2Mg+CO2  2MgO+C
2MgO+C
 2H2O
B . NH3+HCl=NH4Cl
C . 2Na2O2+2H2O=4NaOH+O2↑
D . 2Mg+CO2
2H2O
B . NH3+HCl=NH4Cl
C . 2Na2O2+2H2O=4NaOH+O2↑
D . 2Mg+CO2  2MgO+C
2MgO+C
下列物质中所含的化学键只有离子键的是( )
A . KCl
B . NaOH
C . HCl
D . SO3
下列物质中只含有离子键的是( )
A . H2O2
B . NaCl
C . KOH
D . Cl2
关于化学键的下列叙述中, 正确的是( )
A . 离子化合物中不可能含共价键
B . 共价化合物中可能含离子键
C . 离子化合物中只含离子键
D . 共价化合物中不含离子键
下列晶体中,化学键种类相同、晶体类型也相同的是( )
A . SO3与SiO2
B . NO2与H2O
C . NaCl与HCl
D . CCl4与KCl
下列说法正确的是( )
A . 干冰和石英晶体中的化学键类型相同,熔化时需客服微粒间的作用力类型也相同
B . 化学变化发生时,需要断开反应物中的化学键,并形成生成物中的化学键
C . CH4和CCl4中,每个原子的最外层都具有8电子稳定结构
D . NaHSO4晶体溶于水时,离子键被破坏,共价键不受影响
下列说法正确是( )
A . 元素周期表中共有7个周期,18个族
B . Na2O2、H2SO4、(NH4)2SO4中均有离子键和共价键
C . 酸性:H2SO4>H3PO4>H2CO3>HClO
D . 由于HF分子间存在氢键,所以稳定性:HF>HCl
下列关于化学键的叙述正确的是( )
A . 阴、阳离子通过静电吸引形成的强烈相互作用
B . 仅由非金属元素组成的物质中一定不含离子键
C . 金属元素和非金属元素化合时,不一定形成离子键
D . 只有活泼金属与活泼非金属之间才能形成离子键
下列说法正确的是( )
A . 离子化合物中一定含有金属元素
B . 构成物质的分子中一定含有化学键
C . 非极性键也可能存在于离子化合物中
D . 共价化合物中可能含有离子键
下列化合物中,既有离子键,又有共价键的是( )
A . KOH
B . CaCl2
C . H2O
D . NH3
下列说法正确的是( )
A . 单质分子中都存在化学键
B . NaHSO4溶于水只需要克服离子键
C . 干冰气化,克服了共价键和分子间作用力
D . 晶体熔沸点由高到低的顺序为:金刚石>碳化硅>氯化钠
下列物质中只含离子键的是( )
A . 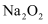 B .
B .  C .
C .  D .
D . 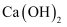
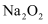 B .
B .  C .
C .  D .
D . 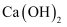
下列叙述错误的是( )
①离子键没有方向性和饱和性,而共价键有方向性和饱和性
②配位键在形成时,是由成键双方各提供一个电子形成共用电子对
③金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
④在冰晶体中,既有极性键、非极性键,又有氢键
⑤化合物NH4Cl和CuSO4·5H2O都存在配位键
⑥NaCl、HF、CH3CH2OH、SO2都易溶于水,但原因不完全相同
A . ①③
B . ②④
C . ②⑤
D . ④⑥
有关物质结构的下列说法中正确的是( )
A . 碘升华时破坏了共价键
B . 氯化钠固体中的离子键在溶于水时被破坏
C . 含极性键共价化合物一定是电解质
D . HF分子间作用力大于HCl,故HF比HCl稳定
下列物质溶于水,既有离子键断裂,又有非极性键断裂的是( )
A . NaHSO4
B . CaH2
C . Na2O2
D . KSCN
人们常在过渡元素中寻找制造催化剂和耐高温、耐腐蚀合金的元素。
-
(1) 纳米TiO2是种应用广泛的催化剂,在太阳光照射下,可以降解酚、醛等多种有机物。22号元素钛位于元素周期表的区,基态钛原子的价层电子轨道表示式为。TiCl4的水解反应可以制得TiO2·xH2O,过滤后再经焙烧可以得到TiO2 , 写出TiCl4水解反应的化学方程式。
-
(2) 铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。对于基态
 原子,下列叙述错误的是____(填标号)。
A . 核外电子有24种运动状态,处在7个不同的能级上 B . 核外电子排布是[Ar]3d54s1 , 是第四周期元素中未成对电子数最多的元素 C . 4s电子能量较高,总是在比3s电子离核更远的地方运动 D . 电负性比钾大,原子对键合电子的吸引力比钾大
原子,下列叙述错误的是____(填标号)。
A . 核外电子有24种运动状态,处在7个不同的能级上 B . 核外电子排布是[Ar]3d54s1 , 是第四周期元素中未成对电子数最多的元素 C . 4s电子能量较高,总是在比3s电子离核更远的地方运动 D . 电负性比钾大,原子对键合电子的吸引力比钾大 -
(3) 我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是,晶胞参数为a pm、a pm、c pm,该晶体密度为
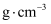 (写出表达式,用a、c和NA表示,
(写出表达式,用a、c和NA表示, )。
)。

下列物质中既含共价键,又含离子键的是( )
A . CaO
B . Ba(OH)2
C . HCl
D . Ne
根据所学物质结构与性质的知识回答下列问题。
-
(1) 超分子化学已逐渐扩展到化学的各个领域。由Mo将2个C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。

①Mo处于第五周期第VIB族,价电子排布与Cr相似,它的基态价电子排布图是,该超分子中存在的化学键类型有(填选项字母)。
A.离子键B.氢键C.σ键D.π键
②该超分子中,配体CO提供孤电子对的原子是(填元素符号),p-甲酸丁酯吡啶配体中C原子的杂化方式有。
-
(2) 氟及其化合物用途非常广泛。
①聚四氟乙烯是一种准晶体,可通过方法区分晶体、准晶体和非晶体。
②AsF3、IF
 、OF2 , BeF2中价层电子对数不同于其它微粒的是(填化学式,下同),其立体构型为。
、OF2 , BeF2中价层电子对数不同于其它微粒的是(填化学式,下同),其立体构型为。③室温氟穿梭电池的电解质为氟氢离子液体,含HF
 、[(FH)2F]-、[(FH)3F]-等离子,画出[(FH)3F]-的结构式。
、[(FH)2F]-、[(FH)3F]-等离子,画出[(FH)3F]-的结构式。④基于CaF2设计的Born-Haber循环如图所示。

钙的第一电离能为kJ·mol-1;F-F键的键能为kJ·mol-1。
最近更新



