用电子式表示简单的离子化合物和共价化合物的形成 知识点
用电子式表示共价化合物的形成:用电子式表示共价化合物中各元素。共价化合物用电子式表示,再用单箭头连接元素和物质表示共价化合物的形成。
用电子式表示简单的离子化合物和共价化合物的形成 知识点题库
-
(1) 熔化时不需要破坏化学键的是.(填写物质的序号,下同)
-
(2) 属于离子化合物的是,只有离子键的物质是.
-
(3) ①的电子式是,
⑤的形成过程用电子式表示为.
 B . 用电子式表示硫化氢的形成过程
B . 用电子式表示硫化氢的形成过程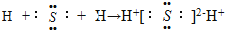 C . HClO的结构式 H﹣O﹣Cl
D . Cl﹣离子的结构示意图
C . HClO的结构式 H﹣O﹣Cl
D . Cl﹣离子的结构示意图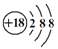
 B .
B . 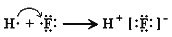 C .
C . 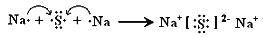 D .
D . 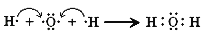
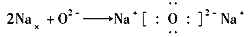 B .
B .  C .
C . 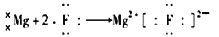 D .
D . 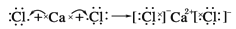
①液氯 ② Cl ③白磷 ④氯气 ⑤红磷 ⑥
Cl ③白磷 ④氯气 ⑤红磷 ⑥ Cl
Cl
(2)下列物质中:只存在共价键的是 (填序号,下同),只存在离子键的是 ,既存在离子键又存在极性共价键的是 ,既存在离子键又存在非极性共价键的是 .
①Ar ②CO2 ③Na2O2④KOH ⑤MgBr2 ⑥NH4Cl ⑦CaO ⑧H2SO4
(3)用电子式表示MgBr2的形成过程:
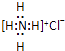 B . 用电子式表示氯化氢分子的形成过程:
B . 用电子式表示氯化氢分子的形成过程: 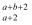 R
R
请回答下列问题:
-
(1) 元素Y在周期表中的位置。
-
(2) Z、M、N三种元素简单离子半径由大到小的顺序是(用元素符号表示)。
-
(3) X与Z能以原子个数比2:1和1:1形成两种化合物,其中既含极性键又含非极性键的化合物的电子式为。
-
(4) Z的简单氢化物比同族元素的简单氢化物沸点(“高”或“低”),原因是。
-
(5) 元素Z和M在常温下可以直接化合,用电子式表示其形成过程。
-
(6) 由以上某些元素组成的化合物A、B、C、D有如下转化关系:
A
 B(在水溶液中进行) , 其中,C是溶于水显酸性的气体;D是淡黄色固体。
B(在水溶液中进行) , 其中,C是溶于水显酸性的气体;D是淡黄色固体。①写出C的结构式:;
②如果A、B均由三种元素组成,且B为两性不溶物。则A和过量的C反应生成B的离子方程式为。
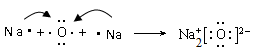 B . CaBr2:
B . CaBr2: 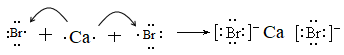 C . KF:
C . KF:  D . MgS:
D . MgS: 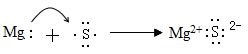
-
(1) 写出A、B、C各元素的名称。
-
(2) 用电子式表示AC形成的一种淡黄色化合物。
-
(3) 用电子式表示BC形成化合物的过程。
-
(4) 用电子式表示A的简单氢化物的形成过程。并解释沸点反常高的原因。
-
(1) 铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)
-
(2) 铝电池性能优越,在现代生产、生活中有广泛的应用。铝-空气电池以其环保、安全而受到越来越多的关注,其原理如下图所示。

该电池的正极反应方程式为 ;电池中NaCl溶液的作用是 ;以该电池为电源,用惰性电极电解Na2SO4溶液,当Al电极质量减少1.8g时,电解池阴极生成的气体在标准状况下的体积为L。
-
(3) AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN),且生成N2。NaN3晶体中阴、阳离子个数比为,写出反应化学方程式为
-
(4) 同主族的元素应用广泛。2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
①基态Ga原子价电子排布式,核外电子占据最高能级的电子云形状为;基态As原子最高能层上有个电子。
②镓失去电子的逐级电离能(单位:kJ/mol)的数值依次为577、1985、2962、6192,-1由此可推知镓的主要化合价为和+3,砷的第一电离能比镓填“大”或“小”)。
③第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为。
④砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中C原子的杂化方式为 ,AsH3分子的空间构型为。
⑤相同压强下,AsH3的沸点NH3(填“大于”或“小于”),原因为。
-
(1) 写出CO2的空间构型:。
-
(2) 写出Na3N的电子式:。
-
(3) 写出C2H6O的化学名称:。
-
(4) 写出乙烯的实验式:。
-
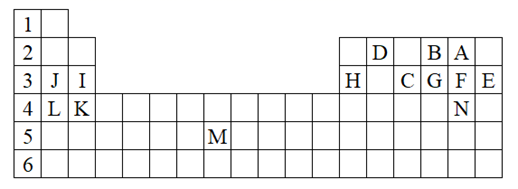
(1) 表中用字母标出的14种元素中,化学性质最不活泼的是(用元素符号表示,下同),金属性最强的是,常温下单质为液态的非金属元素是。
-
(2) B、F、C气态氢化物中以(填分子式)最不稳定。
-
(3) 请用电子式表示J2G的形成过程。
①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大,且原子半径:A>B>C;
②D、E是非金属元素,它们与氢化合可生成气态氢化物HD和H2E,室温下,D的单质是黄绿气体,E的单质是淡黄色固体;
③F是非金属性最强的元素
-
(1) A在加热条件下生成的氧化物的电子式为,含有的化学键类型有,D在元素周期表的位置是。
-
(2) 用电子式表示B、D元素形成的化合物的形成过程:。
-
(3) 比较D和E的氢化物稳定性强弱:(填化学式)。D、E、F简单离子半径由大到小为(填离子符号)。
-
(4) C的最高价氧化物对于的水化物的化学式为;和A的最高价氧化物对应的水化物反应的离子方程式为。
-
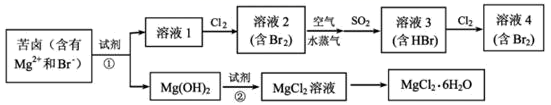
(1) 写出一种海水淡化的方法:。
-
(2) 用电子式表示 MgCl2的形成过程: 。
-
(3) 工业上用MgCl2 制取 Mg 一般常用的方法是________。A . 电解法 B . 还原剂还原法 C . 热分解法 D . 铝热法
-
(4) 提取溴的过程中,经过2次Br-⟶Br2转化的目的是 。
-
(5) 反应①,SO2被Br2氧化为
 ,则该反应中消耗的n(SO2):n(Br2)=;反应②的离子方程式为 。
,则该反应中消耗的n(SO2):n(Br2)=;反应②的离子方程式为 。
-
(6) 用下面提供的试剂,设计简单的实验证明Br 的非金属性比 I 强。(已知Br2 和I2溶在水中浓度较稀时都呈黄色)。。(可选择的试剂:溴水、碘水、KI 溶液、四氯化碳、氯水、淀粉溶液。)
-
(1) 元素B在周期表中的位置;
-
(2) C2A4的结构式为:,用电子式表示E2D的形成过程:。
-
(3) C、D、E形成的简单离子的半径由大到小的顺序为:。(用离子符号表示)
-
(4) E的最高价氧化物对应的水化物与F的最高价氧化物对应的水化物之间发生的化学反应方程式为:。
-
(5) 向KI溶液中通入适量的F单质后,再滴加一定量的CCl4 , 振荡静置后,继续通入F单质并充分振荡,混合溶液逐渐变为无色,若1mol还原剂转移10NA电子,上述反应的化学方程式为:。
 B . 由Na和Cl形成离子键的过程:
B . 由Na和Cl形成离子键的过程: 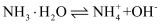 D . 石灰水敞口存放,出现白色固体:
D . 石灰水敞口存放,出现白色固体: 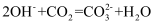
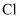 形成
形成  的过程:
的过程:  中心原子的杂化轨道类型:
中心原子的杂化轨道类型: 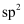 D . 聚乙烯的链节:
D . 聚乙烯的链节: 
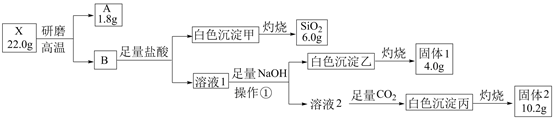
-
(1) 操作①的名称是。
-
(2) 写出白色沉淀丙与氢氧化钠溶液反应的离子方程式是。
-
(3) X的化学式是。
-
(4) 用电子式表示固体1所含物质的形成过程。
-
(1) C元素在周期表中的位置为;由A、C、D三种元素组成的化合物中含有的化学键为。
-
(2) 用电子式表示BC2的形成过程:。
-
(3) 废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式:。
-
(4) 元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,其电子式为, DA能与水反应放出氢气,若将1 mol DA和1 mol E单质混合加入足量的水,充分反应后生成的气体在标准状况下的体积是L。



