极性键和非极性键 知识点
极性键:是在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性。这样的共价键叫做极性共价键,简称极性键
非极性键:当电子对两边的原子不同时,对电子的吸引力就不同,就会使电子对偏向于电负性大的原子。形成极性。当电子对两边的原子相同时,对电子的吸引了就相同,电子就不偏向哪边原子,形成非极性。
非极性键:当电子对两边的原子不同时,对电子的吸引力就不同,就会使电子对偏向于电负性大的原子。形成极性。当电子对两边的原子相同时,对电子的吸引了就相同,电子就不偏向哪边原子,形成非极性。
极性键和非极性键 知识点题库
下列各组物质中,都含有极性键和非极性键的是( )
A . CH4和SiF4
B . H2O2和N2H4
C . NaOH和NH4Cl
D . C2H6和HCOOH
下列说法正确的是( )
A . 以极性键结合起来的分子一定是极性分子
B . 非极性分子中,一定含有非极性共价键
C . 乙醇分子和水分子间只存在范德华力
D . 卤素单质按F2→I2 , 熔沸点逐渐升高
同学们使用的涂改液中含有很多有害的挥发性物质,二氯甲烷就是其中的一种,吸入会引起慢性中毒,有关二氯甲烷的说法正确的是( )
A . 含有非极性共价键
B . 键角均为109°28′
C . 有两种同分异构体
D . 分子属于极性分子
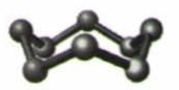
科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体,下列说法正确的是( )

A . 分子中C,N间形成非极性键
B . 1mol该分子中含8mol 二氧化氮
C . 该物质既有氧化性又有还原性
D . 该物质爆炸产物是NO2、CO2、H2O
甲、乙、丙、丁4中物质分别含2种或3种元素,它们的分子中各含18个电子.甲是气态氢化物,在水中分步电离出两种阴离子.下列推断合理的是( )
A . 某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B . 乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C . 丙中含有二周期IVA族的元素,则丙一定是甲烷的同系物
D . 丁和甲中各元素质量比相同,则丁中一定含有﹣1价的元素
两种非金属元素A、B所形成的下列分子中一定属于极性分子的是( )
A . 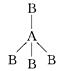 B . B—A—B
C .
B . B—A—B
C . 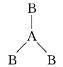 D .
D . 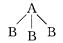
 B . B—A—B
C .
B . B—A—B
C .  D .
D .
下列物质中,只含有非极性共价键的是( )
A . MgCl2
B . Ba(OH)2
C . O2
D . H2O2
关于乙醇分子的说法正确的是( )
A . 分子中共含有8个极性共价键
B . 分子中不含非极性键
C . 分子中只含σ键
D . 分子中含有一个π键
已知以下反应中的四种物质由三种元素组成,其中a的分子立体构型为正四面体形,组成a物质的两种元素的原子序数之和小于10,组成b物质的元素为第三周期元素。下列判断正确的是( )
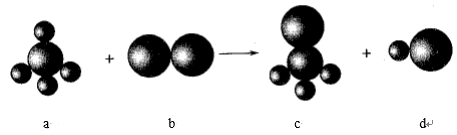
A . 四种分子中的化学键均是极性键
B . a、c分子中中心原子均采用sp3杂化
C . 四种分子中既有σ键,又有π键
D . b、d分子中共价键的键能:b>d
-
(1) 在①NaCl、②NaOH、③Na2O2、④N2、⑤H2S、⑥H2O2中,只含有离子键的是;只含有极性键的是;只含有非极性键的是;既含有离子键,又含有极性键的是;既含有离子键,又含有非极性键的是。
-
(2) 请用电子式表示NaCl的形成过程:。
-
(3) N2的结构式为:;H2O2的结构式为:。
下列说法正确的是( )
A . 由分子组成的物质中一定存在共价键
B . 共价化合物一定含共价键,也可能含离子键
C . 由非金属元素组成的化合物一定是共价化合物
D . 离子化合物一定含离子键,也可能含极性键或非极性键
下列关于丙烯(CH3-CH =CH2)的说法正确的( )
A . 丙烯分子有7个σ键,1个π键
B . 丙烯分子中3个碳原子都是sp3杂化
C . 丙烯分子存在非极性键
D . 丙烯分子中3个碳原子在同一直线上
短周期主族元素X、Y、Z、W的原子序数和族序数均依次增大,其中只有Y、Z处于同一周期,Z是空气中含量最高的元素。下 列说法正确的是( )
A . X、Z两种元素形成的化合物中可能既含极性键,又含非极性键
B . 原子半径:r(Y)>r(Z)
C . W的氧化物对应的水化物-定是强酸
D . W的气态氢化物与W的最高价含氧酸在任何条件下都不发生反应
下列模型分别表示C2H2、S8、SF6的结构,下列说法错误的是( )
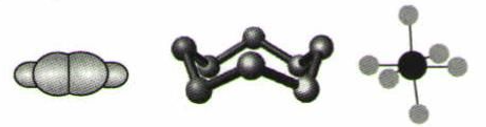
A . 32 Gs8分子中含有0.125 mol σ键
B . SF6是由极性键构成的分子
C . 1 mol C2H2分子中有3 mol σ键和2 mol π键
D . S8中S原子的杂化方式为sp3杂化
观察下列模型并结合有关信息进行判断,下列说法错误的是( )
物质 | HCN | S8 |
结构模型示意图 |
|
|
备注 | - | 易溶于CS2 |
物质 | SF6 | 冰晶体 |
结构模型示意图 |
|
|
A . HCN的结构式为H-C=N
B . 固态硫S8属于分子晶体
C . SF6是由极性键构成的非极性分子
D . 冰晶体熔化时,水分子之间的空隙增大
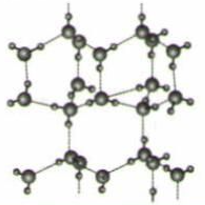
传统的锂离子电池或钠离子电池由于使用有机液态电解液而存在安全问题。发展全固态电池是解决这一问题的必然趋势。 、
、 、
、 是常用的固体电解质。回答下列问题:
是常用的固体电解质。回答下列问题:
 、
、 、
、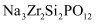 是常用的固体电解质。回答下列问题:
是常用的固体电解质。回答下列问题:
-
(1) 基态Si的电子排布式为。
-
(2) Zr的原子序数为40,位于周期表的第周期ⅣB族。
-
(3)
 、
、 、
、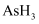 的沸点由高到低的顺序是。
的沸点由高到低的顺序是。
-
(4) 亚磷酸
 是磷元素的一种含氧酸,与NaOH反应只生成
是磷元素的一种含氧酸,与NaOH反应只生成 和
和 两种盐,则
两种盐,则 分子的结构式为,其中P原子的杂化方式为。
分子的结构式为,其中P原子的杂化方式为。
-
(5) Ti能形成化合物
 , 该化合物中
, 该化合物中 的配位数为,在该化合物中不含(填标号)。
的配位数为,在该化合物中不含(填标号)。A.
 键 B.
键 B. 键 C.配位键 D.离子键 E.极性键 F.非极性键
键 C.配位键 D.离子键 E.极性键 F.非极性键 -
(6) 我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为
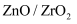 固溶体。四方
固溶体。四方 晶胞如图所示。A原子的坐标为
晶胞如图所示。A原子的坐标为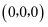 , B原子的坐标为
, B原子的坐标为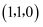 , 则C原子的坐标为。该晶体密度为
, 则C原子的坐标为。该晶体密度为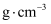 (写出表达式)。在
(写出表达式)。在 中掺杂少量ZnO后形成的催化剂,化学式可表示为
中掺杂少量ZnO后形成的催化剂,化学式可表示为 , 则
, 则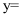 (用x表达)。
(用x表达)。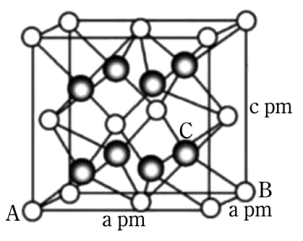
下列分子中既有极性共价键又有非极性共价键的是( )
A .  B .
B .  C .
C .  D .
D . 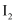
 B .
B .  C .
C .  D .
D . 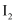
实验室制备乙炔的反应为CaC2+2H2O=Ca(OH)2+C2H2↑。下列有关描述正确的是( )
A . CaC2的电子式: B . 钙的原子结构示意图:
B . 钙的原子结构示意图: C . Ca(OH)2中含有非极性键
D . 该反应属于氧化还原反应
C . Ca(OH)2中含有非极性键
D . 该反应属于氧化还原反应
 C . Ca(OH)2中含有非极性键
D . 该反应属于氧化还原反应
C . Ca(OH)2中含有非极性键
D . 该反应属于氧化还原反应
光气(COCl2)是一种重要的有机中间体。实验室可用反应CHCl3+H2O2=COCl2↑+HCl+H2O制备光气。下列叙述错误的是( )
A . CHCl3的空间结构为正四面体
B . COCl2的电子式为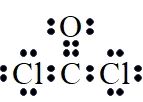 C . H2O2既含有极性键又有非极性键
D . Cl-比O2-原子核外多一个电子层
C . H2O2既含有极性键又有非极性键
D . Cl-比O2-原子核外多一个电子层
我国科学家最近成功合成了世界上首个五氮阴离子盐 (用R代表)。经X射线衍射测得化合物R的晶体局部结构如图所示(已知
(用R代表)。经X射线衍射测得化合物R的晶体局部结构如图所示(已知 是平面结构)。下列说法错误的是( )
是平面结构)。下列说法错误的是( )
 (用R代表)。经X射线衍射测得化合物R的晶体局部结构如图所示(已知
(用R代表)。经X射线衍射测得化合物R的晶体局部结构如图所示(已知 是平面结构)。下列说法错误的是( )
是平面结构)。下列说法错误的是( )
A . 化合物R中存在极性键和非极性键
B . 化合物R中存在氢键
C .  中氧原子采取
中氧原子采取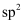 杂化,
杂化, 中氮原子采取
中氮原子采取 杂化
D . 阴离子
杂化
D . 阴离子 中氮原子是
中氮原子是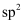 杂化
杂化
 中氧原子采取
中氧原子采取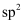 杂化,
杂化, 中氮原子采取
中氮原子采取 杂化
D . 阴离子
杂化
D . 阴离子 中氮原子是
中氮原子是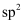 杂化
杂化
最近更新