жһҒжҖ§й”®е’ҢйқһжһҒжҖ§й”® зҹҘиҜҶзӮ№йўҳеә“
дёӢеҲ—еҸҷиҝ°дёӯпјҢжӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . C60жә¶дәҺCS2еҸҜз”Ёзӣёдјјзӣёжә¶еҺҹзҗҶи§ЈйҮҠ
B . дёӨз§Қе…ғзҙ з»„жҲҗзҡ„еҲҶеӯҗдёӯдёҖе®ҡеҸӘжңүжһҒжҖ§й”®
C . еҲҶеӯҗдёӯеҺҹеӯҗзҡ„з»„жҲҗе’ҢжҺ’еҲ—зӣёеҗҢеҲҷдёҖе®ҡжҳҜеҗҢдёҖз§ҚеҲҶеӯҗ
D . еҶ°з»“жһ„дёӯпјҲеҰӮеӣҫ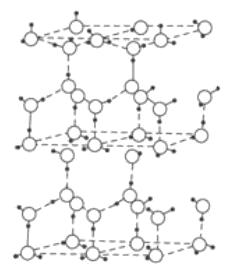 пјүжҜҸдёӘж°ҙеҲҶеӯҗеҸҜд»Ҙе’ҢдәҢдёӘж°ҙеҲҶеӯҗеҪўжҲҗж°ўй”®
пјүжҜҸдёӘж°ҙеҲҶеӯҗеҸҜд»Ҙе’ҢдәҢдёӘж°ҙеҲҶеӯҗеҪўжҲҗж°ўй”®
 пјүжҜҸдёӘж°ҙеҲҶеӯҗеҸҜд»Ҙе’ҢдәҢдёӘж°ҙеҲҶеӯҗеҪўжҲҗж°ўй”®
пјүжҜҸдёӘж°ҙеҲҶеӯҗеҸҜд»Ҙе’ҢдәҢдёӘж°ҙеҲҶеӯҗеҪўжҲҗж°ўй”®
зұ»жҜ”жҳҜдёҖз§Қеёёи§Ғзҡ„еӯҰд№ ж–№жі•пјҢдёӢеҲ—зұ»жҜ”жҺЁж–ӯжӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . й“ҒйҒҮжө“зЎқй…ёеҸ‘з”ҹй’қеҢ–пјҢй“ңйҒҮжө“зЎқй…ёд№ҹеҸ‘з”ҹй’қеҢ–пјӣ
B . и“қиүІзҹіи•ҠиҜ•зәёйҒҮзЁҖзЎ«й…ёеҸҳзәўиүІпјҢи“қиүІзҹіи•ҠиҜ•зәёйҒҮжө“зЎ«й…ёд№ҹеҸҳжҲҗзәўиүІпјӣ
C . CH4жҳҜжһҒжҖ§й”®жһ„жҲҗзҡ„йқһжһҒжҖ§еҲҶеӯҗпјҢCCl4д№ҹжҳҜжһҒжҖ§й”®жһ„жҲҗзҡ„йқһжһҒжҖ§еҲҶеӯҗпјӣ
D . й“ҒдёҺзЁҖзЎқй…ёдҪңз”Ёдә§з”ҹNOпјҢй“ҒдёҺжө“зЎқй…ёдҪңз”Ёд№ҹдә§з”ҹNOпјӣ
дёӢеҲ—еҸҷиҝ°дёӯжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)
A . NH3гҖҒCOгҖҒCO2йғҪжҳҜжһҒжҖ§еҲҶеӯҗ
B . CH4гҖҒCCl4йғҪжҳҜеҗ«жңүжһҒжҖ§й”®зҡ„йқһжһҒжҖ§еҲҶеӯҗ
C . HFгҖҒHClгҖҒHBrгҖҒHIзҡ„зЁіе®ҡжҖ§дҫқж¬Ўеўһејә
D . CS2гҖҒH2OгҖҒC2H2йғҪжҳҜзӣҙзәҝеҪўеҲҶеӯҗ
еҗ«дёӢеҲ—еҢ–еӯҰй”®зҡ„зү©иҙЁпјҢеҸҜиғҪдёәеҚ•иҙЁзҡ„жҳҜпјҲВ В пјү
A . еҸӘжңүзҰ»еӯҗй”®зҡ„зү©иҙЁ
B . ж—ўжңүзҰ»еӯҗй”®пјҢеҸҲжңүйқһжһҒжҖ§й”®зҡ„зү©иҙЁ
C . ж—ўжңүжһҒжҖ§й”®пјҢеҸҲжңүзҰ»еӯҗй”®зҡ„зү©иҙЁ
D . еҸӘжңүйқһжһҒжҖ§й”®зҡ„зү©иҙЁ
еҲҶзұ»жҳҜеҢ–еӯҰз ”з©¶зҡ„йҮҚиҰҒж–№жі•пјҢдёӢеҲ—еҗ„з»„зү©иҙЁзҡ„еҲҶзұ»жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . еҗҢдҪҚзҙ пјҡD2гҖҒH2гҖҒT2
B . еҗ«жһҒжҖ§й”®гҖҒз”ұеҲҶеӯҗжһ„жҲҗзҡ„еҢ–еҗҲзү©пјҡCO2гҖҒCCl4гҖҒNH3
C . йқһз”өи§ЈиҙЁпјҡNH3гҖҒC2H5OHгҖҒCl2
D . еҗҢзі»зү©пјҡ 
дёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . еңЁеҲҶеӯҗдёӯпјҢдёӨдёӘжҲҗй”®зҡ„еҺҹеӯҗй—ҙзҡ„и·қзҰ»еҸ«еҒҡй”®й•ҝ
B . Hп№ЈClзҡ„й”®иғҪдёә431.8 kJвҖўmolп№Ј1 пјҢ Hп№ЈIзҡ„й”®иғҪдёә298.7 kJвҖўmolп№Ј1 пјҢ иҝҷеҸҜд»ҘиҜҙжҳҺHClеҲҶеӯҗжҜ”HIеҲҶеӯҗзЁіе®ҡ
C . еҗ«жңүжһҒжҖ§й”®зҡ„еҲҶеӯҗдёҖе®ҡжҳҜжһҒжҖ§еҲҶеӯҗ
D . й”®иғҪи¶ҠеӨ§пјҢиЎЁзӨәиҜҘеҲҶеӯҗи¶Ҡе®№жҳ“еҸ—зғӯеҲҶи§Ј
дёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)гҖҖгҖҖгҖҖгҖҖгҖҖ гҖҖ гҖҖгҖҖгҖҖгҖҖгҖҖ
в‘ жүҖжңүеҹәжҖҒеҺҹеӯҗзҡ„ж ёеӨ–з”өеӯҗжҺ’еёғйғҪйҒөеҫӘжһ„йҖ еҺҹзҗҶ
в‘ЎеҗҢдёҖе‘Ёжңҹзҡ„дё»ж—Ҹе…ғзҙ д»Һе·ҰеҲ°еҸі,е…ғзҙ зҡ„第дёҖз”өзҰ»иғҪгҖҒз”өиҙҹжҖ§йғҪжҳҜйҖҗжёҗеўһеӨ§зҡ„гҖҖв‘ўжүҖжңүзҡ„еҢ–еӯҰй”®е’Ңж°ўй”®йғҪе…·жңүзӣёеҗҢзҡ„зү№еҫҒ:ж–№еҗ‘жҖ§е’ҢйҘұе’ҢжҖ§гҖҖв‘ЈжүҖжңүзҡ„й…ҚеҗҲзү©йғҪеӯҳеңЁй…ҚдҪҚй”®,жүҖжңүеҗ«й…ҚдҪҚй”®зҡ„еҢ–еҗҲзү©йғҪжҳҜй…ҚеҗҲзү©гҖҖв‘ӨжүҖжңүеҗ«жһҒжҖ§й”®зҡ„еҲҶеӯҗйғҪжҳҜжһҒжҖ§еҲҶеӯҗгҖҖв‘ҘжүҖжңүзҰ»еӯҗжҷ¶дҪ“дёӯйғҪеҗ«жңүзҰ»еӯҗй”®гҖҖв‘ҰжүҖжңүйҮ‘еұһжҷ¶дҪ“зҡ„зҶ”зӮ№йғҪй«ҳдәҺеҲҶеӯҗжҷ¶дҪ“зҡ„зҶ”зӮ№
A . в‘ в‘Ўв‘Ұ
B . в‘Ҙ
C . в‘ўв‘Јв‘Ө
D . в‘ в‘Ўв‘Ҙ
дәҢж°ҜеҢ–дәҢзЎ«пјҲS2Cl2пјүжҳҜе№ҝжіӣз”ЁдәҺж©Ўиғ¶е·Ҙдёҡзҡ„зЎ«еҢ–еүӮпјҢеёёжё©дёӢжҳҜдёҖз§Қж©ҷй»„иүІжңүжҒ¶иҮӯзҡ„ж¶ІдҪ“пјҢе®ғзҡ„еҲҶеӯҗз»“жһ„дёҺH2O2зұ»дјјпјҢзҶ”зӮ№дёә193KпјҢжІёзӮ№дёә411KпјҢйҒҮж°ҙеҫҲе®№жҳ“ж°ҙи§ЈпјҢдә§з”ҹзҡ„ж°”дҪ“иғҪдҪҝе“ҒзәўиӨӘиүІпјҢS2Cl2еҸҜз”ұе№ІзҮҘж°Ҝж°”йҖҡе…ҘзҶ”иһҚзҡ„зЎ«дёӯеҲ¶еҫ—гҖӮдёӢеҲ—жңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲпјү
A . S2Cl2зҡ„з”өеӯҗејҸдёә  B . еӣәжҖҒж—¶S2Cl2еұһдәҺеҺҹеӯҗжҷ¶дҪ“
C . S2Cl2дёҺNaOHзҡ„еҢ–еӯҰж–№зЁӢејҸеҸҜиғҪдёәпјҡS2Cl2+6NaOH=2NaCl+Na2SO3+Na2S+3H2O
D . S2Cl2жҳҜеҗ«жңүжһҒжҖ§й”®е’ҢйқһжһҒжҖ§й”®зҡ„зҰ»еӯҗеҢ–еҗҲзү©
B . еӣәжҖҒж—¶S2Cl2еұһдәҺеҺҹеӯҗжҷ¶дҪ“
C . S2Cl2дёҺNaOHзҡ„еҢ–еӯҰж–№зЁӢејҸеҸҜиғҪдёәпјҡS2Cl2+6NaOH=2NaCl+Na2SO3+Na2S+3H2O
D . S2Cl2жҳҜеҗ«жңүжһҒжҖ§й”®е’ҢйқһжһҒжҖ§й”®зҡ„зҰ»еӯҗеҢ–еҗҲзү©
дёӢеҲ—зү©иҙЁдёӯпјҢж—ўеҗ«жңүзҰ»еӯҗй”®пјҢеҸҲеҗ«жңүйқһжһҒжҖ§е…ұд»·й”®зҡ„жҳҜпјҲ пјү
A . K2O2
B . NaOH
C . MgCl2
D . H2O2
зҺ°жңүеҰӮдёӢеҗ„иҜҙжі•пјҡв‘ з”ұйқһйҮ‘еұһе…ғзҙ еҪўжҲҗзҡ„еҚ•иҙЁдёӯдёҖе®ҡеӯҳеңЁйқһжһҒжҖ§й”®пјӣв‘Ўжҙ»жіјйҮ‘еұһе’Ңжҙ»жіјйқһйҮ‘еұһеҢ–еҗҲж—¶дёҖиҲ¬еҪўжҲҗзҰ»еӯҗй”®пјӣв‘ўйқһйҮ‘еұһе…ғзҙ й—ҙеҪўжҲҗзҡ„еҢ–еҗҲзү©дёҖе®ҡжҳҜе…ұд»·еҢ–еҗҲзү©пјӣв‘Јж №жҚ®з”өзҰ»ж–№зЁӢејҸHCl=H++ClпјҚ пјҢ еҲӨж–ӯHClеҲҶеӯҗйҮҢеӯҳеңЁзҰ»еӯҗй”®пјӣв‘ӨеҶ°зҡ„еҜҶеәҰжҜ”ж°ҙзҡ„еҜҶеәҰе°ҸпјҢиҝҷдёҺж°ўй”®жңүе…ігҖӮдёҠиҝ°еҗ„з§ҚиҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү
A . в‘ в‘Ўв‘Ө
B . в‘ в‘Ўв‘Ј
C . в‘ в‘ўв‘Ј
D . в‘ўв‘Јв‘Ө
зҺ°жңүдёүз§Қзҹӯе‘Ёжңҹе…ғзҙ пјҡв‘ Hпјӣв‘ЎNaпјӣв‘ўClгҖӮ
-
пјҲ1пјү в‘Ўзҡ„еҚ•иҙЁеңЁв‘ўзҡ„еҚ•иҙЁдёӯзҮғзғ§пјҢдә§з”ҹзҷҪзғҹпјҢеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜпјҢз”ҹжҲҗзү©жҳҜеҢ–еҗҲзү©(еЎ«вҖңзҰ»еӯҗвҖқжҲ–вҖңе…ұд»·вҖқ)гҖӮ
-
пјҲ2пјү в‘ дёҺв‘ўеҪўжҲҗзҡ„еҢ–еҗҲзү©зҡ„з”өеӯҗејҸжҳҜпјҢиҜҘеҢ–еҗҲзү©дёӯеҗ«жңүе…ұд»·й”®(еЎ«вҖңжһҒжҖ§вҖқжҲ–вҖңйқһжһҒжҖ§вҖқ)гҖӮ
XгҖҒYгҖҒZгҖҒWжҳҜеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§зҡ„еүҚеӣӣе‘Ёжңҹе…ғзҙ гҖӮеҹәжҖҒXеҺҹеӯҗзҡ„2pиҪЁйҒ“дёҠжңү4дёӘз”өеӯҗпјҢXгҖҒYеҗҢдё»ж—ҸпјҢYгҖҒZеҗҢе‘ЁжңҹпјҢеҹәжҖҒZеҺҹеӯҗиғҪйҮҸжңҖй«ҳзҡ„иғҪзә§дёҠжңү1дёӘжңӘжҲҗеҜ№з”өеӯҗпјҢеҹәжҖҒWеҺҹеӯҗзҡ„3dиғҪзә§дёҠеҸӘжңү1еҜ№жҲҗеҜ№з”өеӯҗгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . ж°”жҖҒж°ўеҢ–зү©зҡ„зғӯзЁіе®ҡжҖ§пјҡYпјһX
B . Y2Z2еҲҶеӯҗдёӯеӯҳеңЁжһҒжҖ§й”®е’ҢйқһжһҒжҖ§й”®
C . еҠ зғӯжқЎд»¶дёӢпјҢZдёҺWзҡ„еҚ•иҙЁеҢ–еҗҲз”ҹжҲҗWZ2
D . 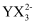 зҡ„з©әй—ҙжһ„еһӢдёәе№ійқўдёүи§’еҪў
зҡ„з©әй—ҙжһ„еһӢдёәе№ійқўдёүи§’еҪў
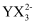 зҡ„з©әй—ҙжһ„еһӢдёәе№ійқўдёүи§’еҪў
зҡ„з©әй—ҙжһ„еһӢдёәе№ійқўдёүи§’еҪў
дёӢеҲ—еҗ„з»„еҲҶеӯҗдёӯпјҢйғҪеұһдәҺеҗ«жһҒжҖ§й”®зҡ„йқһжһҒжҖ§еҲҶеӯҗзҡ„жҳҜ( )
A . CO2гҖҒH2S
B . NH3гҖҒHCl
C . P4гҖҒCCl4
D . C2H4гҖҒCH4
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ( )
A . HFгҖҒHClгҖҒHBrгҖҒHIзҡ„зҶ”гҖҒжІёзӮ№дҫқж¬ЎеҚҮй«ҳ
B . CH4гҖҒCCl4йғҪжҳҜеҗ«жңүжһҒжҖ§й”®зҡ„йқһжһҒжҖ§еҲҶеӯҗ
C . CS2гҖҒH2SCпјҢH2йғҪжҳҜзӣҙзәҝеҪўеҲҶеӯҗ
D . еңЁж°ҙдёӯзҡ„жә¶и§ЈжҖ§пјҡжҲҠйҶҮ>д№ҷдәҢйҶҮ>д№ҷйҶҮ
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . еҸҜзҮғеҶ° дёӯз”Ізғ·еҲҶеӯҗдёҺж°ҙеҲҶеӯҗй—ҙеҪўжҲҗдәҶж°ўй”®
B . вҖң
дёӯз”Ізғ·еҲҶеӯҗдёҺж°ҙеҲҶеӯҗй—ҙеҪўжҲҗдәҶж°ўй”®
B . вҖң вҖқдёүеҺҹеӯҗдёҚеңЁдёҖжқЎзӣҙзәҝдёҠж—¶пјҢдёҚеҸҜиғҪеҪўжҲҗж°ўй”®
C . йқһжһҒжҖ§еҲҶеӯҗдёӯеҸҜиғҪеҗ«жңүжһҒжҖ§й”®
D . еҚӨзҙ еҚ•иҙЁгҖҒеҚӨзҙ ж°ўеҢ–зү©зҡ„зҶ”жІёзӮ№еқҮйҡҸзқҖзӣёеҜ№еҲҶеӯҗиҙЁйҮҸзҡ„еўһеӨ§иҖҢеҚҮй«ҳ
вҖқдёүеҺҹеӯҗдёҚеңЁдёҖжқЎзӣҙзәҝдёҠж—¶пјҢдёҚеҸҜиғҪеҪўжҲҗж°ўй”®
C . йқһжһҒжҖ§еҲҶеӯҗдёӯеҸҜиғҪеҗ«жңүжһҒжҖ§й”®
D . еҚӨзҙ еҚ•иҙЁгҖҒеҚӨзҙ ж°ўеҢ–зү©зҡ„зҶ”жІёзӮ№еқҮйҡҸзқҖзӣёеҜ№еҲҶеӯҗиҙЁйҮҸзҡ„еўһеӨ§иҖҢеҚҮй«ҳ
 дёӯз”Ізғ·еҲҶеӯҗдёҺж°ҙеҲҶеӯҗй—ҙеҪўжҲҗдәҶж°ўй”®
B . вҖң
дёӯз”Ізғ·еҲҶеӯҗдёҺж°ҙеҲҶеӯҗй—ҙеҪўжҲҗдәҶж°ўй”®
B . вҖң вҖқдёүеҺҹеӯҗдёҚеңЁдёҖжқЎзӣҙзәҝдёҠж—¶пјҢдёҚеҸҜиғҪеҪўжҲҗж°ўй”®
C . йқһжһҒжҖ§еҲҶеӯҗдёӯеҸҜиғҪеҗ«жңүжһҒжҖ§й”®
D . еҚӨзҙ еҚ•иҙЁгҖҒеҚӨзҙ ж°ўеҢ–зү©зҡ„зҶ”жІёзӮ№еқҮйҡҸзқҖзӣёеҜ№еҲҶеӯҗиҙЁйҮҸзҡ„еўһеӨ§иҖҢеҚҮй«ҳ
вҖқдёүеҺҹеӯҗдёҚеңЁдёҖжқЎзӣҙзәҝдёҠж—¶пјҢдёҚеҸҜиғҪеҪўжҲҗж°ўй”®
C . йқһжһҒжҖ§еҲҶеӯҗдёӯеҸҜиғҪеҗ«жңүжһҒжҖ§й”®
D . еҚӨзҙ еҚ•иҙЁгҖҒеҚӨзҙ ж°ўеҢ–зү©зҡ„зҶ”жІёзӮ№еқҮйҡҸзқҖзӣёеҜ№еҲҶеӯҗиҙЁйҮҸзҡ„еўһеӨ§иҖҢеҚҮй«ҳ
N2е’ҢH2еңЁеӮ¬еҢ–еүӮиЎЁйқўеҗҲжҲҗж°Ёзҡ„еҫ®и§ӮеҺҶзЁӢеҸҠиғҪйҮҸеҸҳеҢ–зҡ„зӨәж„ҸеӣҫеҰӮдёӢпјҢз”Ё гҖҒ
гҖҒ гҖҒ
гҖҒ еҲҶеҲ«иЎЁзӨәN2гҖҒH2гҖҒNH3 пјҢ е·ІзҹҘпјҡN2(g)+3H2(g)вҮҢ2NH3(g)пјҢиҜҘеҸҚеә”еұһдәҺж”ҫзғӯеҸҚеә”гҖӮдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲ пјү
еҲҶеҲ«иЎЁзӨәN2гҖҒH2гҖҒNH3 пјҢ е·ІзҹҘпјҡN2(g)+3H2(g)вҮҢ2NH3(g)пјҢиҜҘеҸҚеә”еұһдәҺж”ҫзғӯеҸҚеә”гҖӮдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲ пјү

A . в‘ЎвҶ’в‘ўиҝҮзЁӢпјҢжҳҜеҗёзғӯиҝҮзЁӢ
B . в‘ўвҶ’в‘ЈиҝҮзЁӢпјҢNеҺҹеӯҗе’ҢHеҺҹеӯҗеҪўжҲҗдәҶеҗ«жңүжһҒжҖ§й”®зҡ„NH3
C . еҗҲжҲҗж°ЁеҸҚеә”дёӯпјҢеҸҚеә”зү©ж–ӯй”®еҗёж”¶зҡ„иғҪйҮҸеӨ§дәҺз”ҹжҲҗзү©еҪўжҲҗж–°й”®йҮҠж”ҫзҡ„иғҪйҮҸ
D . еҗҲжҲҗж°ЁеҸҚеә”дёӯпјҢеҸҚеә”зү©жҖ»иғҪйҮҸеӨ§дәҺз”ҹжҲҗзү©жҖ»иғҪйҮҸ
й”ӮжҳҜй«ҳиғҪз”өжұ зҡ„зҗҶжғіиҙҹжһҒпјҢеёёз”Ёд№ҷи…ҲгҖҒдәҢз”Іеҹәз”Ій…°иғәзӯүжңүжңәжә¶еүӮе’Ң гҖҒLiBrзӯүз”өи§ЈиҙЁеҲ¶жҲҗй”Ӯйқһж°ҙз”өжұ гҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
гҖҒLiBrзӯүз”өи§ЈиҙЁеҲ¶жҲҗй”Ӯйқһж°ҙз”өжұ гҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
 гҖҒLiBrзӯүз”өи§ЈиҙЁеҲ¶жҲҗй”Ӯйқһж°ҙз”өжұ гҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
гҖҒLiBrзӯүз”өи§ЈиҙЁеҲ¶жҲҗй”Ӯйқһж°ҙз”өжұ гҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . д№ҷи…Ҳ( )дёӯзўіеҺҹеӯҗзҡ„жқӮеҢ–иҪЁйҒ“зұ»еһӢдёә
)дёӯзўіеҺҹеӯҗзҡ„жқӮеҢ–иҪЁйҒ“зұ»еһӢдёә B .
B .  дёӯеӯҳеңЁзҰ»еӯҗй”®гҖҒе…ұд»·й”®е’Ңй…ҚдҪҚй”®
C . LiBrе…·жңүNaClеһӢжҷ¶дҪ“з»“жһ„пјҢ
дёӯеӯҳеңЁзҰ»еӯҗй”®гҖҒе…ұд»·й”®е’Ңй…ҚдҪҚй”®
C . LiBrе…·жңүNaClеһӢжҷ¶дҪ“з»“жһ„пјҢ зҡ„й…ҚдҪҚж•°жҳҜ12
D . дәҢз”Іеҹәз”Ій…°иғә(
зҡ„й…ҚдҪҚж•°жҳҜ12
D . дәҢз”Іеҹәз”Ій…°иғә( )дёӯеӯҳеңЁжһҒжҖ§й”®е’ҢйқһжһҒжҖ§й”®
)дёӯеӯҳеңЁжһҒжҖ§й”®е’ҢйқһжһҒжҖ§й”®
 )дёӯзўіеҺҹеӯҗзҡ„жқӮеҢ–иҪЁйҒ“зұ»еһӢдёә
)дёӯзўіеҺҹеӯҗзҡ„жқӮеҢ–иҪЁйҒ“зұ»еһӢдёә B .
B .  дёӯеӯҳеңЁзҰ»еӯҗй”®гҖҒе…ұд»·й”®е’Ңй…ҚдҪҚй”®
C . LiBrе…·жңүNaClеһӢжҷ¶дҪ“з»“жһ„пјҢ
дёӯеӯҳеңЁзҰ»еӯҗй”®гҖҒе…ұд»·й”®е’Ңй…ҚдҪҚй”®
C . LiBrе…·жңүNaClеһӢжҷ¶дҪ“з»“жһ„пјҢ зҡ„й…ҚдҪҚж•°жҳҜ12
D . дәҢз”Іеҹәз”Ій…°иғә(
зҡ„й…ҚдҪҚж•°жҳҜ12
D . дәҢз”Іеҹәз”Ій…°иғә(
еңЁRu-Rh(й’Ңй“‘)еҹәеӮ¬еҢ–еүӮиЎЁйқўеҸ‘з”ҹеҸҚеә”еҲ¶еӨҮд№ҷй…ёзҡ„дёҖз§ҚжңәзҗҶеҰӮеӣҫпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү

A . иҜҘиҝҮзЁӢдёӯеҸҚеә”в‘ в‘Өзҡ„еҸҚеә”зұ»еһӢзӣёеҗҢ
B . еҸҚеә”в‘ўдёӯж—ўжңүйқһжһҒжҖ§й”®зҡ„ж–ӯиЈӮпјҢеҸҲжңүйқһжһҒжҖ§й”®зҡ„еҪўжҲҗ
C . еҲ¶еҸ–д№ҷй…ёзҡ„жҖ»ж–№зЁӢејҸдёәпјҡCO2+H2+CH3OH CH3COOH+H2O
D . LiIд№ҹжҳҜиҜҘеҸҚеә”зҡ„еӮ¬еҢ–еүӮ
CH3COOH+H2O
D . LiIд№ҹжҳҜиҜҘеҸҚеә”зҡ„еӮ¬еҢ–еүӮ
 CH3COOH+H2O
D . LiIд№ҹжҳҜиҜҘеҸҚеә”зҡ„еӮ¬еҢ–еүӮ
CH3COOH+H2O
D . LiIд№ҹжҳҜиҜҘеҸҚеә”зҡ„еӮ¬еҢ–еүӮ
е·ІзҹҘ еҸ‘з”ҹж°ҙи§ЈеҸҚеә”зҡ„жңәзҗҶеҰӮеӣҫпјҡ
еҸ‘з”ҹж°ҙи§ЈеҸҚеә”зҡ„жңәзҗҶеҰӮеӣҫпјҡ
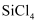 еҸ‘з”ҹж°ҙи§ЈеҸҚеә”зҡ„жңәзҗҶеҰӮеӣҫпјҡ
еҸ‘з”ҹж°ҙи§ЈеҸҚеә”зҡ„жңәзҗҶеҰӮеӣҫпјҡ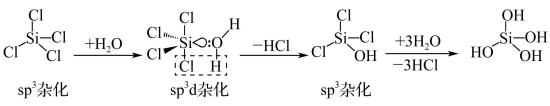
дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . 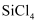 дёҺHSiClOеқҮеұһдәҺжһҒжҖ§еҲҶеӯҗ
B .
дёҺHSiClOеқҮеұһдәҺжһҒжҖ§еҲҶеӯҗ
B . 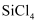 зҡ„й”®и§’дёҺзҷҪзЈ·(
зҡ„й”®и§’дёҺзҷҪзЈ·( )зҡ„й”®и§’еқҮдёә60В°
C .
)зҡ„й”®и§’еқҮдёә60В°
C . 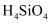 еҠ зғӯеҲҶи§Јеҫ—еҲ°зҡ„
еҠ зғӯеҲҶи§Јеҫ—еҲ°зҡ„ жҷ¶дҪ“дёӯжңҖе°ҸзҺҜжҳҜеҚҒдәҢе…ғзҺҜ
D . зӯүзү©иҙЁзҡ„йҮҸзҡ„
жҷ¶дҪ“дёӯжңҖе°ҸзҺҜжҳҜеҚҒдәҢе…ғзҺҜ
D . зӯүзү©иҙЁзҡ„йҮҸзҡ„ дёҺ
дёҺ жҷ¶дҪ“еҗ«жңүзӣёеҗҢж•°зӣ®зҡ„
жҷ¶дҪ“еҗ«жңүзӣёеҗҢж•°зӣ®зҡ„ й”®
й”®
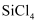 дёҺHSiClOеқҮеұһдәҺжһҒжҖ§еҲҶеӯҗ
B .
дёҺHSiClOеқҮеұһдәҺжһҒжҖ§еҲҶеӯҗ
B . 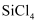 зҡ„й”®и§’дёҺзҷҪзЈ·(
зҡ„й”®и§’дёҺзҷҪзЈ·( )зҡ„й”®и§’еқҮдёә60В°
C .
)зҡ„й”®и§’еқҮдёә60В°
C . 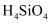 еҠ зғӯеҲҶи§Јеҫ—еҲ°зҡ„
еҠ зғӯеҲҶи§Јеҫ—еҲ°зҡ„ жҷ¶дҪ“дёӯжңҖе°ҸзҺҜжҳҜеҚҒдәҢе…ғзҺҜ
D . зӯүзү©иҙЁзҡ„йҮҸзҡ„
жҷ¶дҪ“дёӯжңҖе°ҸзҺҜжҳҜеҚҒдәҢе…ғзҺҜ
D . зӯүзү©иҙЁзҡ„йҮҸзҡ„ дёҺ
дёҺ жҷ¶дҪ“еҗ«жңүзӣёеҗҢж•°зӣ®зҡ„
жҷ¶дҪ“еҗ«жңүзӣёеҗҢж•°зӣ®зҡ„ й”®
й”®
жҹҗжҒ’жҳҹеҶ…йғЁеҸ‘з”ҹзҡ„дёҖз§Қж ёеҸҚеә”дёә X+
X+ He
He
 Y+
Y+ HпјҢXгҖҒYдёәзҹӯе‘Ёжңҹе…ғзҙ пјҢXзҡ„е‘ЁжңҹеәҸж•°жҳҜе…¶ж—ҸеәҸж•°зҡ„3еҖҚгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
HпјҢXгҖҒYдёәзҹӯе‘Ёжңҹе…ғзҙ пјҢXзҡ„е‘ЁжңҹеәҸж•°жҳҜе…¶ж—ҸеәҸж•°зҡ„3еҖҚгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
 X+
X+ He
He
 Y+
Y+ HпјҢXгҖҒYдёәзҹӯе‘Ёжңҹе…ғзҙ пјҢXзҡ„е‘ЁжңҹеәҸж•°жҳҜе…¶ж—ҸеәҸж•°зҡ„3еҖҚгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
HпјҢXгҖҒYдёәзҹӯе‘Ёжңҹе…ғзҙ пјҢXзҡ„е‘ЁжңҹеәҸж•°жҳҜе…¶ж—ҸеәҸж•°зҡ„3еҖҚгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A .  Yзҡ„иҙЁйҮҸж•°дёә24
B . ж°Ұж°”дёӯеҗ«жңүйқһжһҒжҖ§й”®
C . з®ҖеҚ•зҰ»еӯҗеҚҠеҫ„еӨ§е°Ҹе…ізі»пјҡX>Y
D . XгҖҒYзҡ„ж°ҜеҢ–зү©ж°ҙжә¶ж¶ІеқҮе‘ҲдёӯжҖ§
Yзҡ„иҙЁйҮҸж•°дёә24
B . ж°Ұж°”дёӯеҗ«жңүйқһжһҒжҖ§й”®
C . з®ҖеҚ•зҰ»еӯҗеҚҠеҫ„еӨ§е°Ҹе…ізі»пјҡX>Y
D . XгҖҒYзҡ„ж°ҜеҢ–зү©ж°ҙжә¶ж¶ІеқҮе‘ҲдёӯжҖ§
 Yзҡ„иҙЁйҮҸж•°дёә24
B . ж°Ұж°”дёӯеҗ«жңүйқһжһҒжҖ§й”®
C . з®ҖеҚ•зҰ»еӯҗеҚҠеҫ„еӨ§е°Ҹе…ізі»пјҡX>Y
D . XгҖҒYзҡ„ж°ҜеҢ–зү©ж°ҙжә¶ж¶ІеқҮе‘ҲдёӯжҖ§
Yзҡ„иҙЁйҮҸж•°дёә24
B . ж°Ұж°”дёӯеҗ«жңүйқһжһҒжҖ§й”®
C . з®ҖеҚ•зҰ»еӯҗеҚҠеҫ„еӨ§е°Ҹе…ізі»пјҡX>Y
D . XгҖҒYзҡ„ж°ҜеҢ–зү©ж°ҙжә¶ж¶ІеқҮе‘ҲдёӯжҖ§
жңҖиҝ‘жӣҙж–°



