化学键和分子间作用力的区别 知识点题库
第28届国际地质大会提供的资料显示,在海底蕴藏着大量的天然气水合物,俗称“可燃冰”(CH4·nH2O)。其蕴藏量是地球上煤和石油的几百倍,因而是一种等待开发的巨大能源物质。下列有关可燃冰的预测中错误的是( )。
A . 高压、低温有助于可燃冰的形成
B . 可燃冰的主要成分是甲烷
C . 可燃冰的微粒间可能存在着离子键
D . 构成可燃冰的原子间存在着极性共价键
请指出下列过程需要破坏的作用力
①离子键 ②极性共价键 ③非极性共价键 ④氢键 ⑤分子间作用力
(1)干冰熔化 ;
(2)氢氧化钠溶于水 ;
(3)过氧化钠溶于水 ;
(4)氯化氢气体溶于水 ;
(5)冰熔化 .
金属原子与CO形成的配合物称为金属羰基配合物(如羰基铁).形成配合物时,每个CO提供一对电子与金属原子形成配位键,且金属原子的价电子和CO提供的电子总和等于18.
(1)金属羰基配合物中,微粒间作用力有 (填字母代号)
a、离子键 b、共价键 c、配位键 d、金属键
(2)羰基铁是一种黄色油状液体,熔点﹣21℃、沸点102.8℃.由此推测,固体羰基铁更接近于 (填晶体类型).若用Fe(CO)x表示羰基铁的化学式,则x= .
下列物质性质的变化规律与分子间作用力有关的是( )
A . HF,HCl、HBr、HI的热稳定性依次减弱
B . 金刚石的硬度大于硅,其熔、沸点也高于硅
C . NaF,NaCl、NaBr、NaI的熔点依次降低
D . F2、Cl2、Br2、I2的沸点依次升高
你认为下列说法不正确的是( )
A . 氢键存在于分子之间,不存在于分子之内
B . 对于组成和结构相似的分子,其范德华力随着相对分子质量的增大而增大
C . NH3极易溶于水而CH4难溶于水的原因只是NH3是极性分子,CH4是非极性分子
D . 冰熔化时只破坏分子间作用力
在“冰→液体水→氢气和氧气”的变化过程中,微粒间被破坏的作用力依次是( )
A . 范德华力、范德华力
B . 范德华力、共价键
C . 共价键、范德华力
D . 共价键、共价键
共价键、离子键、范德华力和氢键都是微观粒子之间的不同作用力,下列物质:①Na2O2 ②冰 ③金刚石 ④碘单质 ⑤CaCl2 ⑥白磷,其中只含有两种作用力的组合是( )
A . ①④⑥
B . ①③⑥
C . ②④⑥
D . ①②③⑥
下列说法正确的是( )
A . 干冰和石英晶体中的化学键类型相同,熔化时需克服微粒间的作用力类型也相同
B . 某物质在熔融态能导电,则该物质中一定含有离子键
C . N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
D . NaHSO4晶体溶于水时,只有离子键被破坏
下列说法错误的是( )
A . 碘单质的升华过程中,只需克服分子间作用力
B . BaCl2属于离子化合物,该晶体中只存在离子键
C . 化学键的断裂与形成一定伴随着电子的转移和能量变化
D . NaHSO4和NaHCO3两种晶体溶于水时,被破坏的作用既有离子键又有共价键
在解释下列物质性质的变化规律与物质结构间的因果关系中,与键的强弱无关的变化规律是( )
A . HF、HCl、HBr、HI的热稳定性依次减弱
B . NaF、NaCl、NaBr、NaI的熔点依次降低
C . F2、Cl2、Br2、I2的熔、沸点逐渐升高
D . H2S的稳定性小于H2O的稳定性
2010年诺贝尔物理学奖所指向的是碳的又一张奇妙脸孔:人类已知的最薄材料——石墨烯。下列说法中,正确的是( )
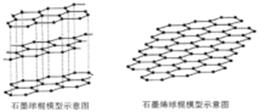
A . 固态时,碳的各种单质的晶体类型相同
B . 石墨烯含有极性键
C . 从石墨剥离得石墨烯需要破坏化学键
D . 石墨烯具有导电性
下列变化中,既有旧化学键断裂,又有新化学键形成的是( )
A . 酒精溶解于水
B . 氯化钠受热熔融
C . 碘单质受热产生紫色气体
D . 碳酸氢铵受热产生刺激性气味
如图所示,每条折线表示元素周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化情况,每个小黑点代表一种氢化物,其中a点代表的是( )

A . H2S
B . HCl
C . PH3
D . SiH4
下列说法正确的个数为( )
①化学键断裂,一定发生化学变化
②任何物质中都存在化学键
③氢键是极弱的化学键
④离子键就是阴、阳离子之间的静电吸引力
⑤活泼金属与活泼非金属化合时能形成离子键
⑥任何共价键中,成键原子成键后均满足稳定结构
⑦验证化合物是否为离子化合物的实验方法是可以看其熔化状态下能否导电
⑧两种非金属元素形成的化合物不可能含有离子键
A . 1
B . 2
C . 3
D . 4
选择下列物质填空(填写序号):①金刚石 ②干冰 ③氩晶体 ④白磷 ⑤氯化钙 ⑥过氧化钠⑦石英 ⑧石墨 ⑨氯化铵 ⑩铜晶体
-
(1) 固态时能导电的有
-
(2) 熔化时不破坏化学键的有
-
(3) 含有配位键的有
-
(4) 含有非极性共价键的有
下列关于化学键的说法中,不正确的是( )
A . 化学反应过程包含反应物中化学键断裂和生成物中化学键形成
B . 氯化氢气体溶解于水产生氢离子和氯离子的过程中有共价键被破坏
C . 化学键是相邻原子或离子间强烈相互作用
D . 氢键属于一种化学键
聚合物锂离子电池具有超薄化特征,适用于多种设备,电极材料涵盖 、
、 、
、 、
、 等物质。
等物质。
 、
、 、
、 、
、 等物质。
等物质。
-
(1) 磷酸为磷的最高价含氧酸,其空间结构如图:

①键角大小比较:
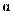
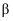 (填“大于”“等于”或“小于”)。
(填“大于”“等于”或“小于”)。②纯净的磷酸黏度极大,随温度升高黏度迅速下降,原因是。
-
(2) 聚合物锂离子电池工作时,
 沿聚乙二醇分子中的碳氧链迁移,过程如图所示(图中阴离子未画出)。
沿聚乙二醇分子中的碳氧链迁移,过程如图所示(图中阴离子未画出)。
①
 迁移过程中与聚乙二醇分子中O原子间的作用力为(填标号)。
迁移过程中与聚乙二醇分子中O原子间的作用力为(填标号)。a.分子间作用力 b.离子键 c.共价键
②
 的阴离子的空间构型为;基态As原子的最高能级组轨道排布式为。
的阴离子的空间构型为;基态As原子的最高能级组轨道排布式为。 -
(3) 二茂镍
 是具有导电性的有机配合物。镍在周期表中的位置是(填写对应周期、族)。x个原子共用y个电子可表示为
是具有导电性的有机配合物。镍在周期表中的位置是(填写对应周期、族)。x个原子共用y个电子可表示为 , 则环戊二烯离子
, 则环戊二烯离子 中的大
中的大 键可表示为。
键可表示为。
-
(4) 图1为NiO晶胞,与
 距离最近的
距离最近的 有个。
有个。
一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为
 作密置单层排列,
作密置单层排列, 填充其中(如图2),该“单分子层”面积密度为
填充其中(如图2),该“单分子层”面积密度为 , 则
, 则 的半径为nm。(用m、
的半径为nm。(用m、 表示)
表示)
随着科学技术的不断进步,研究物质的手段和途径越来越多, 、
、 、
、 、
、 等己被发现。下列有关说法中,正确的是( )
等己被发现。下列有关说法中,正确的是( )
 、
、 、
、 、
、 等己被发现。下列有关说法中,正确的是( )
等己被发现。下列有关说法中,正确的是( )
A .  与
与 中存在氢键
B .
中存在氢键
B .  与
与 互为同位素
C .
互为同位素
C .  分子中有范德华力
D . 1个
分子中有范德华力
D . 1个 中含有24个价电子
中含有24个价电子
 与
与 中存在氢键
B .
中存在氢键
B .  与
与 互为同位素
C .
互为同位素
C .  分子中有范德华力
D . 1个
分子中有范德华力
D . 1个 中含有24个价电子
中含有24个价电子
若不断地升高温度,实现"雪花→水→水蒸气→氧气和氢气"的变化。在变化的各阶段被破坏的粒子间主要的相互作用依次是( )
A . 氢键;分子间作用力;非极性键
B . 氢键;氢键;极性键
C . 氢键;极性键;分子间作用力
D . 分子间作用力;氢键;非极性键
下列说法错误的是( )
A . 分子间作用力中最常见的一种是范德华力
B . 范德华力与氢键可同时存在于分子之间
C . 氢键是一种特殊的化学键
D . 氢键除了影响物质的溶沸点外,还影响物质的溶解性和电离
最近更新



