化学电源新型电池 知识点题库
硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC),由于具有比能量高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池,其工作原理如图所示,下列说法正确的是( )
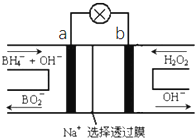

-
(1) 臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如:
6Ag(s)+O3(g)═3Ag2O(s)△H=﹣235.8kJ/mol.
已知2Ag2O(s)═4Ag(s)+O2(g)△H=+62.2kJ/mol,
则常温下反应:2O3(g)═3O2(g)的△H=.
-
(2) 科学家首先使用在酸性条件下电解水的方法制得臭氧.臭氧在阳极周围的水中产生,电极反应式为3H2O﹣6e﹣=O3↑+6H+ , 阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为.
-
(3) O3在碱性条件下可将Na2SO4氧化成Na2S2O8并生成氧气.写出该反应的化学方程式:
-
(4) 所得的Na2S2O8溶液可降解有机污染物4﹣CP.原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4﹣•).通过测定4﹣CP降解率可判断Na2S2O8溶液产生SO4﹣•的量.某研究小组设计实验探究了溶液酸碱性、Fe2+的浓度对产生SO4﹣•的影响.
①溶液酸碱性的影响:其他条件相同,将4﹣CP加入到不同pH的Na2S2O8溶液中,结果如图a所示.由此可知:溶液酸性增强,(填“有利于”或“不利于”)Na2S2O8产生SO4﹣ .
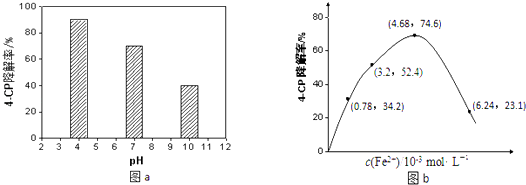
②Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4﹣CP)=1.56×10﹣4mol•L﹣1、c(Na2S2O8)=3.12×10﹣3 mol•L﹣1的混合溶液中.反应240min后测得实验结果如图b所示.已知 S2O82﹣+Fe2+═SO4﹣•+SO42﹣+Fe3+ . 则由图示可知下列说法正确的是:(填序号)
A.反应开始一段时间内4﹣CP降解率随Fe2+浓度的增大而增大,原因是Fe2+能使Na2S2O8产生更多的SO4ˉ•.
B.Fe2+是4﹣CP降解反应的催化剂
C.当c(Fe2+)过大时,4﹣CP降解率反而下降,原因可能是Fe2+会与SO4﹣•发生反应,消耗部分SO4﹣•.
D.4﹣CP降解率反而下降,原因可能是生成的Fe3+水解使溶液的酸性增强,不利于4﹣CP的降解.
③当c(Fe2+)=3.2×10ˉ3mol•L﹣1时,4﹣CP降解的平均反应速率的计算表达式为.

部分阳离子以氢氧化物形式沉淀时的pH如下:
|
沉淀物 |
开始沉淀时的pH |
完全沉淀时的pH |
|
Al(OH)3 |
3.8 |
5.2 |
|
Fe(OH)3 |
2.7 |
3.2 |
|
Fe(OH)2 |
7.6 |
9.7 |
|
Ni(OH)2 |
7.1 |
9.2 |
-
(1) “碱浸”过程中发生反应的离子方程式是
-
(2) “酸浸”时所加入的酸是(填化学式).
-
(3) 加入H2O2时发生反应的离子方程式为
-
(4) 操作b为调节溶液的pH,你认为pH的调控范围是
-
(5) 产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是(写出一点即可).
-
(6) NiSO4•7H2O可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为.

-
(1) NO2可用水吸收,相应的化学方程式为.利用反应6NO2+8NH3
 7N2+12H2O也可以处理NO2 . 当转移1.2mol电子时,消耗的NO2在标准状况下是 L.
7N2+12H2O也可以处理NO2 . 当转移1.2mol电子时,消耗的NO2在标准状况下是 L.
-
(2) 已知:
2SO2(g)+O2(g)⇌2SO3(g)△H=﹣196.6kJ•mol﹣1
2NO (g)+O2(g)⇌2NO2(g)△H=﹣113.0kJ•mol﹣1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO (g) 的△H=kJ•mol﹣1 , 一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是.
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变 d.每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时的NO2与SO2体积比为1:6,则平衡常数K=.
-
(3) CO可用于合成甲醇,反应方程式为CO (g)+2H2(g)⇌CH3OH (g).
①CO在不同温度下的平衡转化率与压强的关系如图1所示.该反应△H0(填“>”或“<”).实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是.
②甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示:通入a气体的电极是原电池的极(填“正”或“负”),其电极反应式为.
|
|
|
|
Ⅰ.碱性锌锰电池 | Ⅱ.铅-硫酸蓄电池 | Ⅲ.铜锌原电池 | Ⅳ.银锌纽扣电池 |


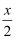 )O2
)O2

 Cd(OH)2 + 2Ni(OH)2 ,有关该电池的说法正确的是( )
Cd(OH)2 + 2Ni(OH)2 ,有关该电池的说法正确的是( )
-
(1) 熔融盐燃料电池具有高的发电效率,因而受到重视。可用熔融的碳酸盐作为电解质,向负极充入燃料气CH4 , 用空气与CO2的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。工作过程中,CO32-移向(填“正”或“负”)极,已知CH4发生反应的电极反应式为CH4+4CO32--8e-=5CO2+2H2O,则另一极的电极反应式为。
-
(2) 利用上述燃料电池,按如图1所示装置进行电解,A、B、C、D均为铂电极,回答下列问题。

Ⅰ.甲槽电解的是200mL一定浓度的NaCl与CuSO4的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计)。
①原混合溶液中NaCl的物质的量浓度为,CuSO4的物质的量浓度为。
②t2时所得溶液的pH=。
Ⅱ.乙槽为200mLCuSO4溶液,乙槽内电解的总离子方程式:;
①当C极析出0.64g物质时,乙槽溶液中生成的H2SO4为 mol。电解后,若使乙槽内的溶液完全复原,可向乙槽中加入 (填字母)。
A.Cu(OH)2 B.CuO
C.CuCO3 D.Cu2(OH)2CO3
②若通电一段时间后,向所得的乙槽溶液中加入0.2mol的Cu(OH)2才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为。
 离子浓度与去除率的关系。下列说法正确的是( )
离子浓度与去除率的关系。下列说法正确的是( ) 
 +7H2O+6e-=2Cr(OH)3+8OH-
B . 电池工作时,N极附近溶液pH减小
C . 处理1 mol
+7H2O+6e-=2Cr(OH)3+8OH-
B . 电池工作时,N极附近溶液pH减小
C . 处理1 mol  时有6 mol H+从交换膜右侧向左侧迁移
D .
时有6 mol H+从交换膜右侧向左侧迁移
D .  离子浓度较大时,可能会造成还原菌失活
离子浓度较大时,可能会造成还原菌失活
|
化学键 |
C=C |
C—C |
C—O |
C—H |
O—H |
|
键能/kJ·mol-1 |
a |
b |
c |
d |
e |
-
(1) 工业上采用乙烯水化法制乙醇:CH2=CH2(g)+H2O(g)=CH3CH2OH(g) ΔH,根据表中键能数据计算ΔH=kJ·mo1-1。
-
(2) 工业上也可采用二氧化碳加氢合成乙醇:2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g)。恒容密闭容器中投入一定量CO2和H2发生上述反应,CO2的平衡转化率与温度、投料比m[m=
 ]的关系如图所示:
]的关系如图所示: 
①投料比由大到小的顺序为(用m1 , m2 , m3表示)。
②某温度下,若投料比m=3,下列可判断反应达到平衡状态的是。
a.容器内气体压强不再变化
b.容器内气体平均相对分子质量不再变化
c.消耗3NA个氢气分子同时生成l.5NA个水分子
d.容器内
 不再变化
不再变化③若开始时投入6molH2和2molCO2 , 容器体积为3L。计算A点温度下该反应的平衡常数K=L4•mol-4;若换为恒压密闭容器,其它条件不变,则A点温度下平衡时CO2的转化率50%(填“>”、“=”或“<”)。
-
(3) 乙醇燃料电池是一种无污染电池,装置如图所示,写出该电池负极的电极反应式。



 为负极
B .
为负极
B . 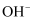 由电极
由电极  区移向电极
区移向电极  区
C . 电池总反应的化学方程式为
区
C . 电池总反应的化学方程式为  D . 若电极区溶液体积不变,一段时间后电极
D . 若电极区溶液体积不变,一段时间后电极  区溶液
区溶液  变大
变大

 C . 工作一段时间后,锌极区pH升高
D . 13.0 gZn参与反应,理论上电路中转移0.2 mol电子
C . 工作一段时间后,锌极区pH升高
D . 13.0 gZn参与反应,理论上电路中转移0.2 mol电子
-
(1) 硫酸铁可用于原水净化,污水处理,是一种高效絮凝剂,写出生成絮凝胶体
 的离子方程式。
的离子方程式。
-
(2) 处理含
 、
、 离子的废水,可以作为沉淀剂。
离子的废水,可以作为沉淀剂。
-
(3) 微生物电池处理镜铭废水的工作原理如图所示。虚线代表离子交换膜(填“阳”或“阴”)。处理过程,a极区附近溶液的pH(填“变大”“变小”或“不变”),每处理1mol
 转移电子mol。
转移电子mol。
-
(4) 处理含硝基苯污水,可先在酸性条件下用铁炭混合物处理(物质转化如图所示),再用双氧水将溶液中的苯胺氧化成
 和
和 。如图中硝基苯被(填“氧化”或“还原”),
。如图中硝基苯被(填“氧化”或“还原”), 是(填“催化剂”或“中间产物”),氧化苯胺时
是(填“催化剂”或“中间产物”),氧化苯胺时 的实际用量比理论用量多,原因是。
的实际用量比理论用量多,原因是。







