铁的吸氧腐蚀 知识点
铁的吸氧腐蚀 知识点题库

时间/波动 | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
A瓶(盛干燥铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
B瓶(盛沾了食盐水的铁丝) | 0 | 0.4 | 1.2 | 3.4 | 5.6 | 7.6 | 9.8 |
C瓶(盛沾了清水的铁丝) | 0 | 0 | 0 | 0.3 | 0.8 | 2.0 | 3.5 |
-
(1) 导管中水面为什么上升?.
-
(2) 上述实验中,铁生锈的速率由大到小的排列顺序为(填小烧瓶代号):.
-
(3) 实验中的铁生锈属于电化学腐蚀的(填腐蚀类型),正极的电极反应为,负极的电极反应为.
选项 | 实验目的 | 实验操作 |
A | 称取3.0gNaOH固体 | 先在托盘上各放一个小烧杯,然后在右盘上添加3g砝码,左盘上添加NaOH 固体 |
B | 制Fe(OH)3 胶体 | 将FeCl3 浓溶液滴入沸水中,并不断搅拌 |
C | 除去Cu中混有的少量Si | 将固体混合物溶于过量的NaOH溶液中,然后过滤、洗涤、干燥 |
D | 验证铁的吸氧腐蚀 | 将铁钉放入试管中,用盐酸浸没 |
|
装置 |
分别进行的操作 |
现象 |
|
|
i. 连好装置一段时间后,向烧杯中滴加酚酞 |
______________ |
|
ii. 连好装置一段时间后,向烧杯中滴加 |
铁片表面产生蓝色沉淀 |
-
(1) 小组同学认为以上两种检验方法,均能证明铁发生了吸氧腐蚀。
①实验i中的现象是。
②用化学用语解释实验i中的现象:。
-
(2) 查阅资料:
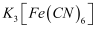 具有氧化性。
具有氧化性。
①据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是。
②进行下列实验,在实验几分钟后的记录如下:
实验
滴管
试管
现象

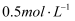
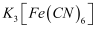 溶液
溶液iii. 蒸馏水
无明显变化
iv. 1.0
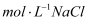 溶液
溶液铁片表面产生大量蓝色沉淀
v.
 溶液
溶液无明显变化
a. 以上实验表明:在条件下,
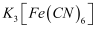 溶液可以与铁片发生反应。
溶液可以与铁片发生反应。b. 为探究
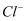 的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后
的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明
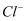 的作用是。
的作用是。 -
(3) 有同学认为上述实验仍不严谨。为进一步探究
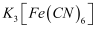 的氧化性对实验ii结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是(填字母序号)。
的氧化性对实验ii结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是(填字母序号)。
实验
试剂
现象
A
酸洗后的铁片、
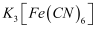 溶液(已除
溶液(已除  )
)产生蓝色沉淀
B
酸洗后的铁片、
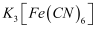 和
和 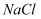 混合溶液(未除
混合溶液(未除  )
)产生蓝色沉淀
C
铁片、
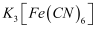 和
和 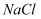 混合溶液(已除
混合溶液(已除  )
)产生蓝色沉淀
D
铁片、
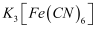 和盐酸混合溶液(已除
和盐酸混合溶液(已除  )
)产生蓝色沉淀
-
(4) 综合以上实验分析,利用实验ii中试剂,设计能证实铁发生了电化学腐蚀的实验方案。
-
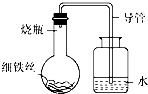
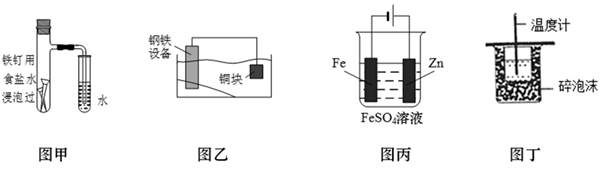
(1) 甲同学设计了 A、B、C三组实验如图:
探究铁生锈的条件。经过较长时间后,甲同学观察到的现象是: A中铁钉生诱;b中铁钉不生锈;C中铁钉不生锈。
①通过上述实验现象分析,可得出铁生锈的外部条件是;
②铁钉发生电化学腐蚀的正极电极反应式为;
③实验B所用的水要经过处理,植物油的作用是;
④实验C中碱石灰的作用是。
-
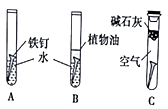
(2) 乙同学为了达到同样目的,设计了实验d如图所示:
发现一段时间后,试管中的液面升高,其原因是,该实验(填“能”或“不能”)说明水对铁钉生锈产生影响。
 模拟吸氧腐蚀
B .
模拟吸氧腐蚀
B . 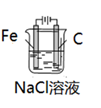 电解法制氯气
C .
电解法制氯气
C .  铁的防护
D .
铁的防护
D .  外加电流的阴极保护法
外加电流的阴极保护法
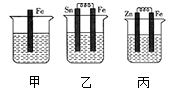
-
(1) 装置丙中
 电极上的电极反应式为。
电极上的电极反应式为。
-
(2) 装置乙中被腐蚀的金属是(填元素符号),比较装置甲、乙、丙中纯铁被腐蚀的速率由快到慢的顺序是。
-
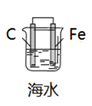
(3) 图丁是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
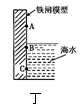
①该电化学腐蚀的类型为腐蚀。
②图中A、B、C三处附近的区域内,腐蚀最严重的是(填序号)。
-
(1) 以
 和
和  为电极,稀
为电极,稀 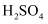 为电解质溶液形成的原电池中:
为电解质溶液形成的原电池中: ①
 向极移动(填“正”或“负”)。
向极移动(填“正”或“负”)。②若有
 流过导线,则理论上负极质量减少g。
流过导线,则理论上负极质量减少g。③若将稀硫酸换成浓硝酸,其负极的电极方程式为:。
-
(2) 氢气是未来最理想的能源,科学家最近研制使海水分解得到氢气的新技术。分解海水时,实现了从太阳能转变为化学能。生成的氢气用于燃料电池时,实现化学能转变为电能。分解海水的反应属于(填“放热”或“吸热”)反应。
-
(3) 有人以化学反应:
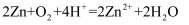 为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它靠人体内血液中溶有一定浓度的
为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它靠人体内血液中溶有一定浓度的  进行工作。则原电池的负极材料是锌,发生的电极反应为。
进行工作。则原电池的负极材料是锌,发生的电极反应为。
-
(4) 常温下,暴露在空气中的生铁容易发生吸氧腐蚀,请写出正极的电极反应式。
| 选项 | A | B | C | D |
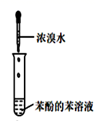
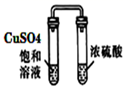
| 实验目的 | 除去苯中的苯酚 | 探究铁的吸氧腐蚀 | 验证浓硫酸的脱水性 | 电解精炼铝 |
| 实验方案 | | | | |
-
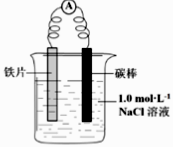
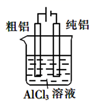
(1) Ⅰ.原电池是化学对人类的一项重大贡献。实验室为研究原电池原理,将 a和b用导线连接,设计如图装置。
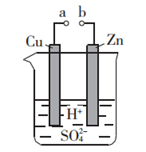
Cu 电极为原电池极(填“正”或“负”),电极反应式为。
-
(2) Zn 电极发生反应(填“氧化”或“还原”)。
-
(3) 溶液中
 移向极(填“Cu”或“Zn”)。
移向极(填“Cu”或“Zn”)。
-
(4) 当 a 和b不连接时,形成原电池(填“能”或“不能”)。
-
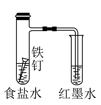
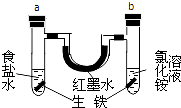
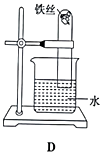
(5) Ⅱ.将除锈后的铁钉(含有少量的碳)用饱和食盐水浸泡一下,放入下图所示的具支试管中。
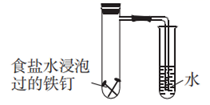
几分钟后,可观察到右边导管中的水柱(填“升高”或“降低”),水柱变化的原因是铁钉发生了电化学腐蚀中的(填“析氢腐蚀”或“吸氧腐蚀”)。
-
(6) 该电化学腐蚀过程中,正极的电极反应式为。
-
(7) Ⅲ.如图X是直流电源,Y池中c、d均为石墨棒,Z池中e、f均为铜棒。接通电路后,发现d附近的溶液显红色。
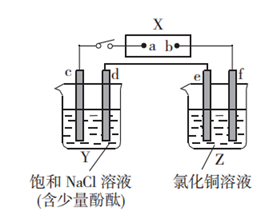
直流电源上 b为极(填“正”或“负”)。
-
(8) Z池中e 为极(填“阳”或“阴”)。
-
(9) 连接 Y、Z池的线路中,电子流动的方向是de(填“→”或“←”)
-
(10) Y池中发生的总反应的化学方程式为。
-
(11) Z池中,e 极的电极反应式为。
选项 | 生产活动 | 化学原理 |
A | 古代科技:我国古代湿法炼铜 | 发生置换反应 |
B | 现代建筑:港珠溴大桥的钢铁护栏涂刷防锈漆 | 钢铁与潮湿空气隔绝可防止腐蚀 |
C | 科学研究:屠呦呦从青蒿中提取青蒿素 | 主要利用蒸馏原理 |
D | 民间艺术:五颜六色的烟花 | 金属和金属离子的焰色反应 |
 D . 科考船只采用电化学保护法提高船体抗腐蚀能力
D . 科考船只采用电化学保护法提高船体抗腐蚀能力
 Na2O2
C . 钢铁在海水中发生吸氧腐蚀的负极反应:Fe-3e-=Fe3+
D . Na2CO3溶液显碱性:CO
Na2O2
C . 钢铁在海水中发生吸氧腐蚀的负极反应:Fe-3e-=Fe3+
D . Na2CO3溶液显碱性:CO +H2O
+H2O HCO
HCO +OH-
+OH-