铁的吸氧腐蚀 知识点题库
钢铁在很弱的酸性或中性条件下发生电化学腐蚀时,正极的反应式为( )
A . Fe-2e-===Fe2+
B . 2H++2e-===H2↑
C . 2H2O+O2+4e-===4OH-
D . Fe-3e-===Fe3+
有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000mL水,加入一定量的NaCl固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm 的细铁丝,将铁丝放入试管中,加入约10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如图.

过一会儿:
-
(1) 观察到试管中的液面逐渐下降,这说明在该条件下,铁丝发生了腐蚀,正极材料是电极反应是
-
(2) 再过一段时间发现液面停止下降,并且开始逐渐上升,露在液面上的铁丝表面由原来的银白色变棕褐色,这说明在该条件下,铁丝发生了腐蚀,正极的电极反应为
①总反应为:;①反应的产物极易被进一步氧化,生成红褐色物质,
②该反应的化学方程式为:若铁锈的组成为:Fe2O3•xH2O,试写出由②反应的产物在通常条件下生成铁锈的反应方程式:
-
(3) 附加题:
已知原来铁丝质量为2g,发生(1)情况时,依液面下降的高度折为标准状况下的体积是5.6mL,则此时,铁丝的质量变为 g,随后液面开始上升,即发生(2)的变化,依最终液面上升的高度折算为标准状况下的体积比最开始刚倒扣于水槽中试管中溶液的体积多了1.12mL,通过计算,(2)的过程共消耗氧气 mL,若x值为2,那么铁丝的质量应为 g(以上计算有效数字保留至小数点后三位)
利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。

下列说法错误的是( )
A . 上述正极反应均为O2+4e-+2H2O=4OH-
B . 在不同溶液中,Cl是影响吸氧腐蚀速率的主要因素
C . 向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快
D . 在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
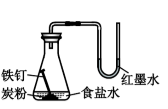
将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( )

A . 铁被氧化的电极反应式为Fe−3e−=Fe3+
B . 铁腐蚀过程中化学能全部转化为电能
C . 活性炭的存在会加速铁的腐蚀
D . 以水代替NaCl溶液,铁不能发生吸氧腐蚀
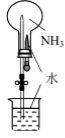
下列图示方法能完成相应实验的是( )
| | | | |
| A.配制一定物质的量浓度的NaOH溶液 | B.实验室制取Cl2 | C.验证铁的析氢腐蚀 | D.验证氨气易溶于水 |
A . A
B . B
C . C
D . D
有关电化学原理的推断正确的是( )
A . 金属腐蚀就是金属原子失去电子被还原的过程
B . 钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e-=4OH-
C . 氯碱工业中,阳极发生的反应为:2Cl-–2e-=Cl2↑
D . 镀锌铁皮的镀层部分损坏后,铁更容易腐蚀
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致现象的主要原因是液滴之下氧气含量比边缘处少。下列说法正确的是( )

A . 液滴中的Cl–由a区向b区迁移
B . 液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH-
C . 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH−形成Fe(OH)2 , 进一步氧化、脱水形成铁锈
D . 若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-=Cu2+
某实验小组利用下列装置探究电解质溶液的浓度对金属腐蚀的影响:
| 装置 | | |
| 现象 | 电流计指针不发生偏转 | 电流计指针发生偏转 |
下列有关说法正确的是( )
A . 装置Ⅰ中的铁片均不会发生任何腐蚀
B . 铁片d上可能发生的电极反应为:Fe-3e-=Fe3+
C . 利用K3[Fe(CN)6]溶液可确定装置Ⅱ中的正、负极
D . 铁片a、c所处的NaCl溶液的浓度相等,二者腐蚀速率相等
炒过菜的铁锅未及时洗净(残液中含有NaCl),不久便会因腐蚀而出现红褐色锈斑。试回答:
-
(1) 铁锅的锈蚀应属于腐蚀。
-
(2) 铁锅锈蚀的电极反应式为:负极:;正极:。正负极反应产物会继续发生反应,反应的离子方程式,化学方程式为。
研究金属的腐蚀与防护意义重大。下列说法错误的是( )
A . 保暖贴在工作过程中,铁发生了吸氧腐蚀
B . 微电解技术处理工业废水过程中,铁屑中的铁和碳分别作为电极外接直流电源
C . 化工厂中盛装酸性溶液的管道,常用外加电流阴极保护法来防止腐蚀
D . 食品包装袋中的以铁为主要成分的双吸剂,能够消耗氧气和水延长食物的保质期
下列有关金属腐蚀的说法正确的是( )
A . 电化学腐蚀是在外加电流作用下不纯金属发生化学反应被损耗的过程
B . 金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生
C . 钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气,产物最终转化为铁锈
D . 镀锌的铁板比镀锡的铁板更容易被腐蚀
下列各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
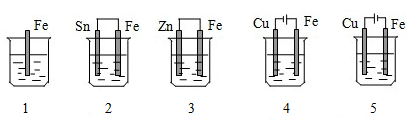
A . 4>2>1>3>5
B . 2>1>5>3>4
C . 5>4>2>3>1
D . 3>5>2>4>1
-
(1) 由氢气和氧气反应生成1mol水蒸气放热242kJ,写出该反应的热化学方程式:。
已知断裂1molH2、1molO2的化学键分别需要消耗436kJ、496kJ的能量,则断裂1molH-O所需的能量为kJ。
-
(2) 已知:①CH4(g)+H2O(g)
 CO(g)+3H2(g)△H1=+205.9kJ•mol-1
CO(g)+3H2(g)△H1=+205.9kJ•mol-1 ②CO(g)+H2O(g)
 CO2(g)+H2(g)△H2=-41.2kJ•mol-1
CO2(g)+H2(g)△H2=-41.2kJ•mol-1则反应③:CH4(g)+CO2(g)
 2CO(g)+2H2(g)△H3=kJ•mol-1。
2CO(g)+2H2(g)△H3=kJ•mol-1。写出反应③的平衡常数表达式K=。
-
(3) 若将反应Cu+2Fe3+=Cu2++2Fe2+设计成原电池,则该电池正极的电极反应式为:。
-
(4) 如图所示,水槽中试管内有一枚铁钉,放置数天后观察,发现试管内液面上升,铁钉表面出现铁锈。该铁钉发生的电化学腐蚀类型为腐蚀,其正极电极反应式为。

将经酸洗除锈的铁钉,用饱和食盐水浸泡后放入如图所示装置中,下列叙述正确的是( )

A . 过一段时间,Ⅱ试管中的导管内水柱上升
B . Ⅰ试管中铁钉由于发生电解反应而被腐蚀
C . 铁钉在该装置中被腐蚀的情况随时间的延长而加快
D . Ⅰ试管中铁钉发生反应的一个电极反应式为:2Cl--2e-=Cl2↑
下列指定化学用语正确的是( )
A . Ba(OH)2的电离方程式: 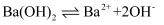 B . 钢铁发生吸氧腐蚀时的正极反应:
B . 钢铁发生吸氧腐蚀时的正极反应: 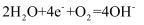 C . Na2S水解的离子方程式:
C . Na2S水解的离子方程式: 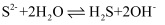 D . 电解NaCl溶液的离子方程式:
D . 电解NaCl溶液的离子方程式: 
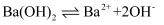 B . 钢铁发生吸氧腐蚀时的正极反应:
B . 钢铁发生吸氧腐蚀时的正极反应: 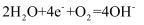 C . Na2S水解的离子方程式:
C . Na2S水解的离子方程式: 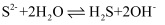 D . 电解NaCl溶液的离子方程式:
D . 电解NaCl溶液的离子方程式: 
如图所示各容器中盛有海水,铁在其中被腐蚀由快到慢的顺序是( )

A . ④>②>①>③
B . ②>①>③>④
C . ③>②>④>①
D . ④>②>③>①
下列有关电化学原理的说法正确的是( )
A . 铝—空气燃料电池以KOH为电解液时,负极反应为: B . 用电解法精炼铜,阳极反应为:
B . 用电解法精炼铜,阳极反应为: C . 钢铁在中性条件下被腐蚀,正极反应为:
C . 钢铁在中性条件下被腐蚀,正极反应为: D . 电解法冶炼铝时,阳极反应为:
D . 电解法冶炼铝时,阳极反应为:
 B . 用电解法精炼铜,阳极反应为:
B . 用电解法精炼铜,阳极反应为: C . 钢铁在中性条件下被腐蚀,正极反应为:
C . 钢铁在中性条件下被腐蚀,正极反应为: D . 电解法冶炼铝时,阳极反应为:
D . 电解法冶炼铝时,阳极反应为:
在表面无锈的铁片上滴食盐水,一段时间后有铁锈出现。此过程反应为:2Fe+2H2O+O2=2Fe(OH)2 , Fe(OH)2进一步被氧气氧化为Fe(OH)3 , 再在一定条件下脱水生成铁锈,其原理如图。下列说法不正确的是( )

A . 铁片发生氧化反应而被腐蚀
B . 铁片腐蚀最严重区域应该是生锈最多的区域
C . 铁片腐蚀中正极发生的电极反应:2H2O+O2+4e-=4OH-
D . 铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀
下列图示与对应的叙述相符的是( )
|
|
|
|
A.验证 | B.蒸发结晶制备 | C.打开活塞,一段时间后,可观察到烧杯内溶液进入试管中 | D.铁片上镀铜 |
A . A
B . B
C . C
D . D
下列说法正确的是( )
A . 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
B . 淀粉、纤维素、油脂、蛋白质等高分子化合物均能发生水解反应
C . 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极保护法
D . 煤中含有大量苯及其同系物,可通过干馏的方法得到苯及其同系物
最近更新






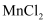 溶液对过氧化氢的分解有催化作用
溶液对过氧化氢的分解有催化作用 晶体
晶体


