铁的吸氧腐蚀 知识点题库
①钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②铁露置在空气中一段时间后就会生锈;性质更活泼的铝不能稳定存在于空气中
③化合物NaCl的焰色为黄色;Na2CO3的焰色也为黄色
④密度为1.1g•cm﹣3与密度为1.2g•cm﹣3的NaCl溶液等体积混合,所得NaCl溶液的密度介于1.1g•cm﹣3与1.2g•cm﹣3之间;NaK合金的熔点应介于Na和K熔点之间.

-
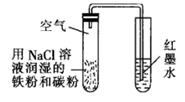
(1) 装置1为铁的吸氧腐蚀实验.一段时间后,向插入铁钉的玻璃筒内滴入KSCN溶液呈无色,再滴入氯水即可观察到铁钉附近的溶液变红色,表明铁被;向插入碳棒的玻璃筒内滴入酚酞试液,可观察到碳棒附近的溶液变红,该电极反应为.
-
(2) 装置2中的石墨是极(填“正”或“负”),该装置发生的总反应的离子方程式为.
-
(3) 装置3中甲烧杯盛放100mL 0.2mol•L﹣1的NaCl溶液,乙烧杯盛放100mL 0.5mol•L﹣1的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞试液,观察到石墨电极附近首先变红.
①电源的M端为极,甲烧杯中铁电极的电极反应为;
②乙烧杯中电解反应的离子方程式为;
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64g,则甲烧杯中产生的气体在标准状况下为 mL.
①铁钉上放出氢气 ②碳棒上放出氯气 ③碳棒上放出氧气 ④铁钉锈蚀 ⑤溶液颜色由无色逐渐变为黄色.
操作 | 现象 |
取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水 |
放置一段时间后,生铁片上出现如右图所示“斑痕”。其边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈 |
下列说法不合理的是
 验证化学能转化为电能
B .
验证化学能转化为电能
B .  验证温度对化学平衡的影响
C .
验证温度对化学平衡的影响
C . 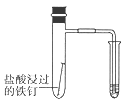 验证铁钉发生吸氧腐蚀
D .
验证铁钉发生吸氧腐蚀
D .  验证AgCl溶解度大于Ag2S
验证AgCl溶解度大于Ag2S

-
(1) 糖类、油脂,蛋白质都是人体必需的营养物质。请回答下列问题:
①向蛋白质溶液中加入饱和(NH4)3SO4溶液可使蛋白质发生(填“盐析”或“变性”)。
②油脂被摄入人体后,在酶的作用下水解生成高级脂肪酸和(填名称)。
③氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基和(填名称)。
④葡萄糖是一种重要的单糖,部分葡萄糖在体内被氧化生成二氧化碳和水,同时放出能量。写出二氧化碳的结构式:。
-
(2) 化学是材料科学发展的基础,合理使用材料有利于人类的生产和生活。请根据题意,选择恰当的选项,用字母代号填空。
①太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置,其主要成分是。
A.硅 B.二氧化硅 C.硅酸
②塑料、合成纤维和合成橡胶是人们常说的三大合成材料。我国航天服外层是用一种特殊的高强度涤纶制成的。涤纶属于。
A.塑料 B.合成纤维 C.合成橡胶
③钢铁在潮湿的空气中容易发生电化学腐蚀,其正极反应为。
A.Fe-2e-=Fe2+
B.O2+2H2O+4e-=4OH-
C.2H++2e-= H2↑
-
(3) 防治环境污染,改善生态环境,已成为全球共识。
①酸雨是指pH小于5.6的降水,下列导致酸雨形成的气体是(填字母代号,下同)。
A.CO2 B.CH4 C.SO2
②废塑料制品选成的“白色污染”已成为社会一大公害。下列治理“白色污染”的方法中,不可取的是。
A.焚烧废塑料 B.减少使用塑料 C.回收和再利用废塑料
③下列措施不利于环境保护的是。
A.推广使用无铅汽油 B.提倡家庭使用太阳能热水器
C.限制使用电动车 D.提倡家庭购买大排量汽车
 Fe(OH)3(胶体)+3H+
C . 钢铁发生吸氧腐蚀,负极反应为:Fe-2e-=Fe2+
D . 盛装强碱溶液的试剂瓶不能用玻璃塞:SiO2+2OH-=
Fe(OH)3(胶体)+3H+
C . 钢铁发生吸氧腐蚀,负极反应为:Fe-2e-=Fe2+
D . 盛装强碱溶液的试剂瓶不能用玻璃塞:SiO2+2OH-=  +H2O
+H2O

| A | B | C | D |
| | | | |
| 制取 | 验证 | 制取少量 | 检验该条件下铁发生了吸氧腐蚀 |
 Fe(OH)3(胶体)+3H+
C . 工业上漂白粉的制备原理:2OH-+Cl2=Cl-+ClO-+H2O
D . 盛装强碱溶液的试剂瓶不能用玻璃塞:SiO2+2OH-=SiO
Fe(OH)3(胶体)+3H+
C . 工业上漂白粉的制备原理:2OH-+Cl2=Cl-+ClO-+H2O
D . 盛装强碱溶液的试剂瓶不能用玻璃塞:SiO2+2OH-=SiO  +H2O
+H2O
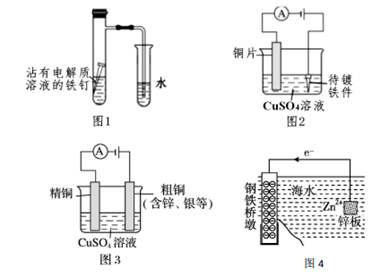
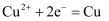 C . 图 3:溶液中 c(Cu2+)增大
D . 图 4:采用了牺牲阳极的阴极保护法保护桥墩
C . 图 3:溶液中 c(Cu2+)增大
D . 图 4:采用了牺牲阳极的阴极保护法保护桥墩
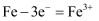 ,发生吸氧腐蚀
B . 电解精炼铜时,阳极为粗铜,阴极为精铜,电解过程中电解质溶液不需要更换
C . 在铁制器皿上镀锌,铁制器皿作阴极,锌片作阳极
D . 二次电池充电时,电池上标有“+”的电极应与外接电源的负极相连
,发生吸氧腐蚀
B . 电解精炼铜时,阳极为粗铜,阴极为精铜,电解过程中电解质溶液不需要更换
C . 在铁制器皿上镀锌,铁制器皿作阴极,锌片作阳极
D . 二次电池充电时,电池上标有“+”的电极应与外接电源的负极相连
-
(1) 铁制品暴露在潮湿空气中容易发生腐蚀,通过图甲所示装置可验证铁钉是否发生电化学腐蚀,正极反应式是。

-
(2) 利用图乙装置可模拟工业生产高铁酸盐,阳极反应为,阴极区的溶液
 (填“增大”“减小”或“不变”)。利用高铁酸盐可制作新型可充电电池,该电池的总反应为
(填“增大”“减小”或“不变”)。利用高铁酸盐可制作新型可充电电池,该电池的总反应为 , 充电时阳极反应为,放电时每转移
, 充电时阳极反应为,放电时每转移 电子,正极有
电子,正极有 被还原。
被还原。



 具有漂白性
具有漂白性



