化学平衡的调控 知识点题库
①颜色;②平均分子量;③质量;④压强;⑤密度.
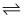 2Q(g),平衡时Q的体积分数与温度和压强的关系如图所示,下列判断正确的是( )
2Q(g),平衡时Q的体积分数与温度和压强的关系如图所示,下列判断正确的是( ) 

-
(1) 反应Ⅰ: 2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) △H1=+551 KJ·mol-1
反应Ⅲ: S(s)+O2(g)=SO2(g) △H3=-297 KJ·mol-1
反应Ⅱ的热化学方程式:。
-
(2) 对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。P2P1(填“>”或“<”),得出该结论的理由是。

-
(3) Ⅰ-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+ =+ +2I-
-
(4) 探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18mLSO2饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)

①B是A的对比实验,则a=。
②比较A、B、C,可得出的结论是。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:。
 溶液、
溶液、  溶液以及
溶液以及  的pH随温度变化的曲线如图所示。下列说法正确的是( )
的pH随温度变化的曲线如图所示。下列说法正确的是( ) 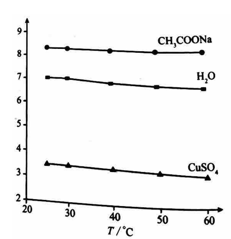
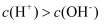 B . 随温度升高,
B . 随温度升高, 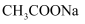 的溶液的
的溶液的 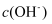 减小
C . 随温度升高,
减小
C . 随温度升高, 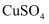 的溶液的pH变化是
的溶液的pH变化是  改变与水解平衡移动共同作用的结果
D . 随水温升高,
改变与水解平衡移动共同作用的结果
D . 随水温升高, 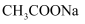 溶液和
溶液和 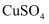 溶液的pH均降低,是因为
溶液的pH均降低,是因为  、
、  水解平衡移动方向不同
水解平衡移动方向不同
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol·L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | а1 | а2 | а3 |
下列说法正确的是( )
 +2H2O⇌Ag++2NH3·H2O,下列说法正确的是( )
+2H2O⇌Ag++2NH3·H2O,下列说法正确的是( )
 Z(g),经2min达到平衡,生成0.6mol Z,下列说法正确的是( )
Z(g),经2min达到平衡,生成0.6mol Z,下列说法正确的是( )
 C . 若增大压强,则物质Y的转化率减小
D . 若升高温度,X的体积分数增大,则该反应是放热反应
C . 若增大压强,则物质Y的转化率减小
D . 若升高温度,X的体积分数增大,则该反应是放热反应
 。则下列说法正确的是( )
。则下列说法正确的是( )
 D . 某溶液中
D . 某溶液中  ,说明此时
,说明此时 
 更接近0.1 mol·L-1 , 可以采取的措施是( )
更接近0.1 mol·L-1 , 可以采取的措施是( )
 +OH-。
+OH-。
-
(1) 进食后,细菌和酶作用于食物,产生有机酸,此时,牙齿就会受到腐蚀,其原因是。
-
(2) 已知Ca5(PO4)3F(s)的溶解度比上面的矿化产物更小,质地更坚固。请用离子方程式表示牙膏配有氟化物添加剂能防止龋齿的原因:。
-
(3) 根据以上原理,请你提出一种其它促进矿化的方法:。
-
(1) 化学沉淀法去除水体中的PO43- , 常用的化合物有AlCl3、Ca(OH)2 等。
①AlCl3溶液中Al3+水解的离子方程式为。
②Ca5(PO4)3OH的Ksp为6.8X10-37 , 其溶度积常数表达式为Ksp[Ca5(PO4)3OH]=。
-
(2) 为探究将废水中氨态氮(NH3-N) 和PO43-同时去除,按n(NH4Cl):nNa2HPO4):n(MgCl2)
=1:1:1加入水中,实验测得不同pH下,氨态氮和PO43-的去除率如图(a)所示:
已知: (I) 去除的主要反应为: Mg2++NH4++HPO42-+6H2O
 MgNH4PO4 6H2O↓+H+ ,
MgNH4PO4 6H2O↓+H+ ,(II)室温时,Ksp(MgNH4PO4 6H2O)=2.5X10-13 , Ksp[Mg(OH)2]= 1.8x10-11 , Ksp[Mg3(PO4)2]=6.3X10-31。
①pH在8.5~10.5时,氨态氮和PO43-去除率随pH增大而增大,其原因是(从平衡移动角度说明)。
②当pH> 10.5时,氨态氮和PO43-去除率随pH增大而减小,其原因是(从平衡移动角度说明)。

-
(3) -种浸没式SMDDC电池可用于去除地下水中硝态氮,其装置如图(b)所示:
①装置工作时,H+向极(填“X”或“Y")室迁移。
②X极上(CH2O)n→CO2 的电极反应式为;
Y极上NO3-→>N2的电极反应式为
 关系如图所示:下列说法错误的是( )
关系如图所示:下列说法错误的是( ) 
 L-1
L-1  min-1
D . c点时,再加入CO2(g)和H2O(g),使二者分压均增大0.05 kPa,α(H2)增大
min-1
D . c点时,再加入CO2(g)和H2O(g),使二者分压均增大0.05 kPa,α(H2)增大
 , 在合成氨工业中常采取的下列措施不能用勒夏特列原理来解释的是( )
, 在合成氨工业中常采取的下列措施不能用勒夏特列原理来解释的是( )

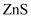 和
和 的沉淀溶解关系如图所示,其中
的沉淀溶解关系如图所示,其中 、
、 , M为
, M为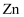 或
或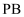 ,
,  表示
表示 。下列说法正确的是( )
。下列说法正确的是( )
 的不饱和溶液
B . 若
的不饱和溶液
B . 若 , 则
, 则 C . 若对A点浊液加热,A点沿曲线向上移动
D . 在
C . 若对A点浊液加热,A点沿曲线向上移动
D . 在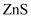 和
和 同时沉淀的浊液中,
同时沉淀的浊液中,

①  (g)
(g) 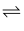
 (g)+H2O(g) ΔH1=+28kJ/mol K1(190℃)=104
(g)+H2O(g) ΔH1=+28kJ/mol K1(190℃)=104
②2  (g)
(g) 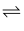
 (g)(二聚异丁烯) ΔH2=-72kJ/mol K2(190℃)=0.1
(g)(二聚异丁烯) ΔH2=-72kJ/mol K2(190℃)=0.1
下列说法错误的是( )
回答下列问题:
-
(1) “CO优先氧化”是向氢气燃料中通入空气,CO优先于H2发生反应。该方法的缺点是降低了燃料的热值、(只答一条即可)。
-
(2) “CO选择性甲烷化”是通过CO加氢生成甲烷而实现CO的深度去除。反应过程:
i.CO (g) +3H2(g)
 CH4(g)+H2O(g) △H1= - 206 kJ·mol-1
CH4(g)+H2O(g) △H1= - 206 kJ·mol-1ii.CO2(g) + 4H2(g)
 CH4(g) + 2H2O(g) △H2
CH4(g) + 2H2O(g) △H2iii.CO2(g) +H2(g)
 CO(g) + H2O(g) △H3= + 41 kJ ·mol-1
CO(g) + H2O(g) △H3= + 41 kJ ·mol-1①△H2 =kJ·mol-1;
②采用“CO选择性甲烷化”的方法消除CO,该方法最明显的缺点是。
③欲使CO体积分数必须低于10 ×10-4% ,应采取的措施是(填标号)。
A.升高温度 B.降低压强 C.使用CO加氢催化剂 D.使用CO2加氢抑制剂
-
(3) 有研究认为CO加氢甲烷化存在下列过程(如图所示),限速步骤是(填标号),从结构上给予解释:。

在某一条件下进行CO加氢甲烷化,发生i、ii和iii反应,相关数据如下:
体积/L
CO
CO2
H2
H2O
CH4
反应前
10
10
80
1.0 ×10-7
1.0 ×10-7
反应后
1.0 ×10-6
10
x
10
10
①x=(保留2位有效数字);
②此条件下反应iii的平衡常数K= 100,通过计算判断反应iii是否平衡。
 在酸催化下存在如下平衡:
在酸催化下存在如下平衡: 。据此推测,对羟基苯甲醛与10倍量的
。据此推测,对羟基苯甲醛与10倍量的 在少量酸催化下反应,达到平衡后,下列化合物中含量最高的是( )
在少量酸催化下反应,达到平衡后,下列化合物中含量最高的是( )

K | Na | KCl | NaCl | |
熔点/℃ | 63.65 | 97.8 | 770 | 801 |
沸点/℃ | 774 | 882.9 | 1500(升华) | 1431 |
根据平衡移动原理可推知,用Na与KCl反应制K的适宜温度是( )



