化学平衡的调控 知识点题库
德国哈伯发明以低成本制造大量氨的方法,流程图中为提高原料转化率而采取措施是( )

另有副反应:2CO+2H2O═CO2+CH4 等;中压法操作:压力为10﹣15MPa,温度控制在513K﹣543K,所用催化剂是CuO﹣ZnO﹣Al2O3 . 合成甲醇的流程如图所示,

请回答:
-
(1) 实际生产中CO不能过量,以免生成羰基铁使催化剂失去活性,而氢气过量是有益的,指出两点理由:、.
-
(2) 采取10﹣15MPa压力的作用是;温度控制在513K﹣543K的原因是.
-
(3) 原料气中的H2S对铜催化剂影响甚重,故必先去除之,通常用生石灰除杂,该反应的化学方程式为:
-
(4) 粗甲醇中含有二甲醚等副产物,在常压下蒸馏粗甲醇,首先获得的馏分是(写结构简式);获得的甲醇又可在银催化下氧化成甲醛,该反应的化学方程式为:.
-
(5) 若CO的转化率为80%,当有22.4M3(标况)CO与过量H2充分反应(不计其它副反应),可制得纯度为96%的甲醇的质量为kg,同时获得热量kJ.
①气缸中生成NO的反应为:N2(g)+O2(g)⇌2NO(g)△H>0.汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因、.
②汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)△H>0,该设想能否实现?(选填“能”或“不能”),依据是.
 2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )
 1/2N2(g)+CO2(g) ΔH=-373.2 kJ/mol,为提高该反应的反应速率,缩短达到平衡的时间,下列措施不可取的是( )
1/2N2(g)+CO2(g) ΔH=-373.2 kJ/mol,为提高该反应的反应速率,缩短达到平衡的时间,下列措施不可取的是( )
①增大氢气的浓度 ②升高温度 ③降低温度 ④缩小体积 ⑤增大HI的浓度 ⑥减小压强
 2CO2(g)+N2(g)△H=-46.8kJ·mol-1 , 可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是( )
2CO2(g)+N2(g)△H=-46.8kJ·mol-1 , 可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是( )
资料:高铁酸钾(K2FeO4)固体呈紫色,能溶于水,微溶于浓KOH溶液。K2FeO4在碱性溶液中性质稳定。
-
(1) 研究人员用Ni、Fe作电极电解浓KOH溶液制备K2FeO4 , 装置示意图如图。

①Ni电极作(填“阴”或“阳”)极。
②Fe电极上的电极反应为。
③循环使用的物质是(填化学式)溶液。
④向阳极流出液中加入饱和KOH溶液,析出紫色固体。试从平衡的角度解释析出固体的原因:。
-
(2) K2FeO4可用于处理废水中的NaCN。用如下方法测定处理后的废水中NaCN的含量(废水中不含干扰测定的物质)。
资料:Ag+ +2CN- =Ag(CN)
 Ag+ + I-=AgI↓(黄色)CN-优先于I-与Ag+反应。
Ag+ + I-=AgI↓(黄色)CN-优先于I-与Ag+反应。取a mL处理后的废水于锥形瓶中,滴加几滴KI溶液作指示剂,再用cmol/LAgNO3溶液滴定,消耗AgNO3溶液的体积为V mL。滴定终点时的现象是,经处理后的废水中NaCN的含量为g/L。(已知:NaCN的摩尔质量:49 g/mol)
 C .
C .  D . Ka(HF)
D . Ka(HF)
 NO+SO3 , 当化学反应达到平衡时,下列叙述正确的是( )。
NO+SO3 , 当化学反应达到平衡时,下列叙述正确的是( )。
-
(1) 已知:①2H2(g)+O2(g)=2H2O(l) △H1=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H2=-1453 kJ·mol-1
则CO2(g)+3H2(g)
 CH3OH(l)+H2O(l) △H3=。
CH3OH(l)+H2O(l) △H3=。 -
(2) 一定温度下,在密闭容器中充入2 mol CO2(g)和6 mol H2(g)发生反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),测得平衡时CH3OH(g)的体积分数与温度、压强的关系如图1:
CH3OH(g)+H2O(g),测得平衡时CH3OH(g)的体积分数与温度、压强的关系如图1: 
①根据图1可判断:p1(填“>”“=”或“<”)p2。
②A点时,用分压表示的平衡常数Kp=(分压=总压×物质的量分数)。
③甲醇燃料电池因具有能量转化率高、电量大的特点而被广泛应用,甲醇KOH碱性燃料电池负极的电极反应式为。
-
(3) 用CO和H2合成甲烷还伴随多个副反应:
主反应:CO(g)+3H2(g)
 CH4(g)+H2O(g) △H=-206 kJ·mol-1
CH4(g)+H2O(g) △H=-206 kJ·mol-1副反应:①2CO(g)
 CO2(g)+C(s) △H=-171.7 kJ·mol-1
CO2(g)+C(s) △H=-171.7 kJ·mol-1②CH4(g)
 C(s)+2H2(g) △H=+73.7 kJ·mol-1
C(s)+2H2(g) △H=+73.7 kJ·mol-1
①在合成气甲烷化过程中,经常使用Ni作为甲烷化的催化剂,但Ni基催化剂对硫、砷等很敏感,极少量的硫、砷也可能导致Ni基催化剂发生而失去活性。
②在高温条件下,导致积碳的主要原因是;不同的氢碳比(即H2、CO的物质的量之比)对CO转化率的影响如图2所示。CO的转化率随着氢碳比的变化而变化的原因是。由图2、图3可知,较为适宜的氢碳比为。
-
(1) 25℃时,pH=2的醋酸溶液中,c(H+);将其加水稀释,
 的值将(填“增大”“减小”或“无法判断”)。
的值将(填“增大”“减小”或“无法判断”)。
-
(2) 醋酸钠溶液呈碱性的原因是(用离子方程式表示),溶液中各离子浓度由大到小的顺序为。
-
(3) 已知25℃时,H2S的Ka1=1.3×10-7、Ka2=7.1×10-15、,则25℃时等浓度的CH3COONa、Na2S两种溶液的碱性较强的是。
-
(4) 日常生活中可用醋酸除水垢,但工业锅炉的水垢中常含有硫酸钙,需先用Na2CO3溶液处理,最后再用NH4Cl溶液除去。已知:25℃时,Ksp(CaCO3)=2.8×10-9、Ksp(CaSO4)=9.1×10-6、,结合化学平衡原理解释加入Na2CO3溶液的原因:(用溶解平衡表达式和必要的文字叙述加以说明)。
 和1mol
和1mol  充入一定容密闭容器中,在催化剂存在下进行反应:
充入一定容密闭容器中,在催化剂存在下进行反应: 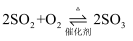 ,下列说法错误的是( )
,下列说法错误的是( )
 和
和  物质的量之和不变
C . 通过调控反应条件,可以提高该反应进行的程度
D . 达到平衡时,容器内压强不再改变
物质的量之和不变
C . 通过调控反应条件,可以提高该反应进行的程度
D . 达到平衡时,容器内压强不再改变
 pC(g),若B是有色物质,A,C均为无色物质,达到平衡后,加入一定量C,体系的颜色会变深
B . 一定温度下两个体积相同密闭容器中,分别放有二氧化氮、气态溴,起始时两个容器中气体颜色相同,若将容器体积压缩至原来的一半,则CNO2>CBr2
C . 综合考虑反应速率和限度,以及催化剂活性,合成氨一般选择400℃~500℃
D . 恒温时,对于反应A(g)+3B(g)
pC(g),若B是有色物质,A,C均为无色物质,达到平衡后,加入一定量C,体系的颜色会变深
B . 一定温度下两个体积相同密闭容器中,分别放有二氧化氮、气态溴,起始时两个容器中气体颜色相同,若将容器体积压缩至原来的一半,则CNO2>CBr2
C . 综合考虑反应速率和限度,以及催化剂活性,合成氨一般选择400℃~500℃
D . 恒温时,对于反应A(g)+3B(g) 2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压为原来的两倍,则A体积分数仍为n%
2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压为原来的两倍,则A体积分数仍为n%

 。当达到平衡时,下列各项措施中,能提高乙烷转化率的是( )
。当达到平衡时,下列各项措施中,能提高乙烷转化率的是( )
 SiHCl3(g)+H2(g)的说法正确的是( )
SiHCl3(g)+H2(g)的说法正确的是( ) 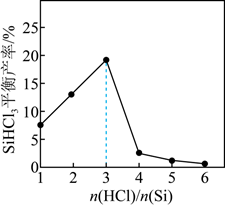
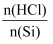 >3,SiHCl3平衡产率减小说明发生了副反应
>3,SiHCl3平衡产率减小说明发生了副反应
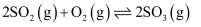
 , 下列说法正确的是( )
, 下列说法正确的是( )
 ,
,  的转化率上升
B . 反应的平衡常数表示为
的转化率上升
B . 反应的平衡常数表示为 C . 使用高效催化剂能降低反应的焓变
D . 升高温度有利于提高
C . 使用高效催化剂能降低反应的焓变
D . 升高温度有利于提高 的平衡转化率
的平衡转化率
 是一种常用的硝化剂,常用
是一种常用的硝化剂,常用 的臭氧化法制备,反应原理如下:
的臭氧化法制备,反应原理如下:
反应I:
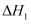
反应II:

-
(1) 298K时,几种物质的相对能量如下表:
物质





能量(kJ/mol)
-90
-14
-62
-181
-198
请可根据物质的相对能量计算反应I的
 (忽略△H随温度的变化)。
(忽略△H随温度的变化)。 -
(2) 在密闭容器中充入
 和
和 , 发生反应I和II。
, 发生反应I和II。
①在恒温恒压条件下,下列说法正确的是。
A.
 和
和 的物质的量之比不变时说明反应已达平衡
的物质的量之比不变时说明反应已达平衡B.
 说明反应Ⅱ已达到平衡
说明反应Ⅱ已达到平衡C.混合气体密度不再改变说明反应Ⅰ已达到平衡
D.反应达到平衡后,再往容器中通入稀有气体Ar,反应Ⅰ平衡不移动
②保持温度不变,对反应体系加压,平衡时
 的转化率
的转化率 与压强的关系如图所示。请解释压强增大至
与压强的关系如图所示。请解释压强增大至 的过程中
的过程中 逐渐增大的原因:。
逐渐增大的原因:。
③保持容器体积2L不变,10min时反应达到平衡,此时
 的转化率为50%,O2的物质的量为0.2mol,反应II的平衡常数K=。
的转化率为50%,O2的物质的量为0.2mol,反应II的平衡常数K=。④以固体催化剂M催化反应I,若O3分子首先被催化剂的活性表面吸附而解离,该反应机理分为两步,写出第二步的化学方程式:步骤a.
 ;步骤b.。
;步骤b.。 -
(3) T℃时,在密闭容器中充入
 , 保持压强不变,只发生反应II,t1时到达平衡,
, 保持压强不变,只发生反应II,t1时到达平衡, 随时间的变化如图所示,在t2时刻继续充入一定量的
随时间的变化如图所示,在t2时刻继续充入一定量的 , t3时刻重新到达平衡,请在图中作出
, t3时刻重新到达平衡,请在图中作出 随时间变化的曲线。
随时间变化的曲线。




