化学平衡的调控 知识点题库

-
(1) 以氨气为原料合成HNO3工艺如下,写出N2O4转化为HNO3的反应方程式。
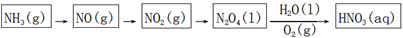
-
(2) 以NH3和CO2为原料生产尿素的反应如下:
反应Ⅰ:2NH3(l) + CO2(g)
 NH2COONH4(l) Δ H1 = a kJ·mol-1
NH2COONH4(l) Δ H1 = a kJ·mol-1 反应Ⅱ:NH2COONH4(l)
 NH2CONH2(l) + H2O(l) Δ H2 = b kJ·mol-1
NH2CONH2(l) + H2O(l) Δ H2 = b kJ·mol-1 ① 已知NH3(l)
 NH3(g) Δ H3 = c kJ·mol-1 反应2NH3(g) + CO2(g)
NH3(g) Δ H3 = c kJ·mol-1 反应2NH3(g) + CO2(g)  NH2CONH2(l) + H2O(l) Δ H4=kJ·mol-1(用含a、b、c的式子表示),该反应能自发进行的主要原因是。
NH2CONH2(l) + H2O(l) Δ H4=kJ·mol-1(用含a、b、c的式子表示),该反应能自发进行的主要原因是。 ② 一定条件下,往恒容密闭容器中投入4 mol NH3和 1 mol CO2 , 测得各组分物质的量随时间变化如图1。下列说法正确的是。
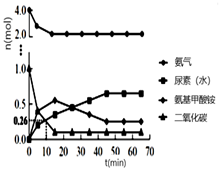
A.选择合适的碳氮比有利于提高产率
B.反应Ⅰ的活化能比反应Ⅱ小
C.过量氨气可以与反应生成的水结合,有利于尿素合成
D.气体物质的量不再变化时,反应达到平衡状态
-
(3) 工业上利用氨气生产氢氰酸的反应为CH4(g) + NH3(g)
 HCN(g) + 3H2(g) Δ H>0
HCN(g) + 3H2(g) Δ H>0 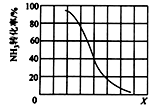
① 其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。X代表的是(填“温度”或“压强”)。
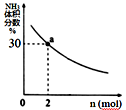
② 其它条件一定时,向2 L密闭容器中加入n mol CH4和2 mol NH3 , 平衡时NH3体积分数随n变化的关系如图所示。平衡常数K=(请写出计算过程)
-
(1) 亚硝酰氯(Cl—N=O)气体是有机合成的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为。
相关化学键的键能如下表所示:
化学键
Cl—Cl
N
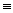 O(NO气体)
O(NO气体) Cl—N
N=O
键能/(kJ·mol-1)
243
630
200
607
-
(2) 燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)
 2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1 , 对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1 , 对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下: 时间/min
浓度/mol·L-1
0
10
20
30
40
50
O2
1.00
0.79
0.60
0.60
0.64
0.64
CO2
0
0.42
0.80
0.80
0.88
0.88
①0~10min内,平均反应速率v(CO2)=mol·L-1·min-1;当升高温度,该反应的平衡常数K(填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是 (填字母)。
A.加入一定量的粉状碳酸钙
B.适当缩小容器的体积
C.通入一定量的O2
D.加入合适的催化剂
-
(3) NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)
 N2(g)+CO2(g) ΔH=-34.0kJ·mol-1 , 用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH=-34.0kJ·mol-1 , 用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示: 
由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=[已知:气体分压(P分)=气体总压(Pa)×体积分数]
-
(4) 为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)
 N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1 , 生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。①达到平衡后,仅降低温度,k正减小的倍数 (填“>”、“<”或“=”)k逆减小的倍数。②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为20%,则
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1 , 生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。①达到平衡后,仅降低温度,k正减小的倍数 (填“>”、“<”或“=”)k逆减小的倍数。②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为20%,则  =(计算结果用分数表示)
=(计算结果用分数表示)
 2B(g)+C(g)+Q(Q>0)的反应速率随时间变化如下图所示,在t1、t2、t3、t4时刻都只有一个条件发生改变。下列判断正确的是( )
2B(g)+C(g)+Q(Q>0)的反应速率随时间变化如下图所示,在t1、t2、t3、t4时刻都只有一个条件发生改变。下列判断正确的是( ) 

 CH4(g)+2H2O(g),若平衡后将温度从300℃升至400℃,保持其他条件不变,反应重新达到平衡时,CO2的体积分数增加。下列有关判断不正确的是( )
CH4(g)+2H2O(g),若平衡后将温度从300℃升至400℃,保持其他条件不变,反应重新达到平衡时,CO2的体积分数增加。下列有关判断不正确的是( )
 溶液与
溶液与 溶液反应的化学反应速率,所用的试剂为
溶液反应的化学反应速率,所用的试剂为 溶液和
溶液和 溶液,所得c(Cl-)随时间变化的曲线如图所示。下列说法正确的是( )
溶液,所得c(Cl-)随时间变化的曲线如图所示。下列说法正确的是( )
 B . 该反应在
B . 该反应在 的平均反应速率
的平均反应速率 C . 在反应过程中,该反应的化学反应速率变化趋势为先增大后减小
D . 起初反应很慢,一段时间后反应速率明显增大,一定是反应放热温度升高的结果
C . 在反应过程中,该反应的化学反应速率变化趋势为先增大后减小
D . 起初反应很慢,一段时间后反应速率明显增大,一定是反应放热温度升高的结果
 排放力争2030年前达到峰值,力争2060年前实现碳中和。回答下列问题:
排放力争2030年前达到峰值,力争2060年前实现碳中和。回答下列问题:
-
(1) 有利于实现“碳达峰、碳中和”的是____(填标号)。A . 燃煤脱硫 B . 粮食酿酒 C . 风能发电 D . 石油裂化
-
(2)
 催化重整可以得到合成气(
催化重整可以得到合成气(
 和
和
 ),对“碳达峰、碳中和”具有重要意义。
),对“碳达峰、碳中和”具有重要意义。
①
 催化重整反应:
催化重整反应:
 , 有利于提高
, 有利于提高
 平衡转化率的条件是(填标号)。
平衡转化率的条件是(填标号)。A.低温高压 B.高温低压 C.高温高压 D.低温低压
②某温度下,在体积为
 的容器中加入
的容器中加入
 以及催化剂进行重整反应,达到平衡时
以及催化剂进行重整反应,达到平衡时
 的转化率是
的转化率是
 , 其平衡常数为
, 其平衡常数为
 。
。③反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应

消碳反应


75
172
活化能(kJ·mol-1)
催化剂X
43
72
催化剂Y
33
91
由上表判断,催化剂XY(填“优于”或“劣于),理由是。
④在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图1所示,升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是(填标号)。

A.K积减小、K消增加 B.v积减小、v消增加
C.K积、K消均增加 D.v消增加的倍数比v积增加的倍数大
⑤在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[(CO2)]-0.5(k为速率常数)。在
 一定时,不同
一定时,不同
 下积碳量随时间的变化趋势如图2所示,则
下积碳量随时间的变化趋势如图2所示,则
 从大到小的顺序为。
从大到小的顺序为。
 ]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
-
(1) Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是COH2(填“大于”或“小于”)。
-
(2) 721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为( )A . <0.25 B . 0.25 C . 0.25~0.50 D . 0.50 E . >0.50
-
(3) 我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。

可知水煤气变换的ΔH0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=eV,写出该步骤的化学方程式。
-
(4) Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的
 和
和 相等、
相等、 和
和 相等。
相等。
计算曲线a的反应在30~90 min内的平均速率
 =
= 。467 ℃时
。467 ℃时 和
和 随时间变化关系的曲线分别是、。489℃时
随时间变化关系的曲线分别是、。489℃时 和
和 随时间变化关系的曲线分别是、。
随时间变化关系的曲线分别是、。
 在电池中有重要应用。以软锰矿(主要成分为
在电池中有重要应用。以软锰矿(主要成分为 )为原料制备粗二氧化锰颗粒的过程如下:
)为原料制备粗二氧化锰颗粒的过程如下:
![]()
-
(1) 浸出
①用硫酸和
 可溶解软锰矿,请补全该反应的离子方程式:
可溶解软锰矿,请补全该反应的离子方程式:□
 +□ +□ =□
+□ +□ =□ +□
+□ □
□ ②浸出时可用
 代替硫酸和
代替硫酸和 。下列说法正确的是(填序号)。
。下列说法正确的是(填序号)。a.
 在反应中作氧化剂
在反应中作氧化剂b.用
 浸出可减少酸的使用
浸出可减少酸的使用c.该法可同时处理烟气中的
 , 减少大气污染
, 减少大气污染 -
(2) 净化、分离
①软锰矿浸出液中的
 、
、 可通过加碱转化为沉淀去除,分离出清液的方法是。
可通过加碱转化为沉淀去除,分离出清液的方法是。②为减少碱用量,可以通过稀释浸出液除去
 , 结合离子方程式解释原理:。
, 结合离子方程式解释原理:。 -
(3) 热解
在一定空气流速下,相同时间内
 热解产物中不同价态
热解产物中不同价态 的占比随热解温度的变化如图。
的占比随热解温度的变化如图。 热解过程中涉及如下化学反应:
热解过程中涉及如下化学反应:i.

ii.

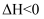
iii.

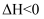

①为了增大产物中
 的占比,可以采用的措施是(答出两条)。
的占比,可以采用的措施是(答出两条)。②温度升高,产物中
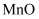 的占比降低,可能的原因是。
的占比降低,可能的原因是。
-
(1) 合成:NH3加压并预热后与压缩的CO2在合成塔中反应生成尿素。
①NH3加压并预热的目的是。
②该反应属于反应(填“氧化还原”或“非氧化还原”)。
③合成中氨碳比[
 ]分别为3和4时,CO2的转化率随温度的变化如图所示。
]分别为3和4时,CO2的转化率随温度的变化如图所示。
则图中曲线1对应的氨碳比为,反应最适宜温度为。
-
(2) 分离:尿素水溶液经蒸发得到尿素。尿素水溶液在加热蒸发过程中会部分水解成(NH4)2CO3或NH4HCO3尿素水解生成(NH4)2CO3的化学方程式为。
 和
和 为原料可以制得淀粉,实现“喝西北风”吃饱;
为原料可以制得淀粉,实现“喝西北风”吃饱; 与
与 可在不同催化剂和反应条件下生成
可在不同催化剂和反应条件下生成 和
和 等多种化合物,在减少温室气体、减少化石能源使用、新能源开发利用等方面有重要的作用。
等多种化合物,在减少温室气体、减少化石能源使用、新能源开发利用等方面有重要的作用。
-
(1) 单个
 分子与
分子与 在催化剂的作用下反应历程如图甲所示:(吸附在催化剂表面的物质用·标注,如
在催化剂的作用下反应历程如图甲所示:(吸附在催化剂表面的物质用·标注,如 表示
表示 吸附在催化剂表面;图中Ts表示过渡态分子)。
吸附在催化剂表面;图中Ts表示过渡态分子)。
反应历程中活化能(能垒)最小的化学方程式为,


-
(2)
 与
与 在某催化剂的作用下反应如图乙所示:
在某催化剂的作用下反应如图乙所示:
化学键





键能

436
326
803
464
414
写出该反应的热化学方程式:,体系达到平衡后,若要使平衡向正反应方向移动,可以改变的条件是(任写一种)
-
(3) 在相同的恒容容器中,
 内三种不同的催化剂对
内三种不同的催化剂对 与
与 反应的影响如图丙所示:
反应的影响如图丙所示:
①下列说法正确的是.
a. 使用催化剂Ⅰ,反应转化率最高
b. 由图得出此反应一定是放热反应
c. 最佳催化剂是催化剂Ⅰ
d. a、b、c三点的速率大小关系一定为:

②若此反应起始投料为
 和
和 , 在10L恒容密闭容器中进行,且反应时间足够长,得到上述关系式,则
, 在10L恒容密闭容器中进行,且反应时间足够长,得到上述关系式,则 温度下,反应的平衡常数K=(用分数形式表示),在催化剂Ⅰ作用下,从起始到a点
温度下,反应的平衡常数K=(用分数形式表示),在催化剂Ⅰ作用下,从起始到a点 的平均反应速率为。
的平均反应速率为。



