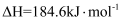燃烧热 知识点
燃烧热 知识点题库
 O2(g)═CO2(g)△H=﹣283kJ•mol﹣1
O2(g)═CO2(g)△H=﹣283kJ•mol﹣1
 C2H5OH(l)+
C2H5OH(l)+ 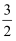 O2(g)=CO2(g)+3/2H2O(l) △H = -Q kJ/mol
D . C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H = -2Q kJ/mol
O2(g)=CO2(g)+3/2H2O(l) △H = -Q kJ/mol
D . C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H = -2Q kJ/mol
-
(1) 已知甲醇的燃烧热为726.5kJ/mol,则甲醇燃烧的热化学方程式为.
-
(2) 利用合成气主要成分为CO和H2)在催化剂的作用下合成甲醇,已知反应中有关物质的化学键键能数据如下表所示:
化学键
H-H
C-O
C≡O
H-O
C-H
E/(kJ/mol)
436
343
1076
465
413
则: CO(g)+2H2(g)⇌CH3OH(g)△H=kJ•mol-1 , 每消耗标准状况下8.96LCO时转移电子的物质的量是.
-
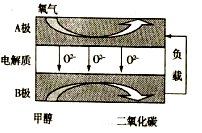
(3) 以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。如图是月前研究较多的一类固体氧化物燃料电池工作原理示意图。B极为电池极,B极的电极反应式为
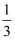 体积,CO2占
体积,CO2占 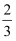 体积,已知:C(s)+
体积,已知:C(s)+  O2(g)=CO(g)△H=-Q1kJ/mol,CO(g)+
O2(g)=CO(g)△H=-Q1kJ/mol,CO(g)+  O2(g)=CO2(g)△H=-Q2kJ/mol,与这些焦炭完全燃烧相比较,损失的热量是中正确的是()
O2(g)=CO2(g)△H=-Q2kJ/mol,与这些焦炭完全燃烧相比较,损失的热量是中正确的是()
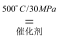 2NH3(g) △H = -38.6kJ•mol-1
D . 已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2Al2O3(s) △H = -2834.9kJ•mol-1 , 4Al(s) + 2O3(g) ═ 2Al2O3(s) △H = -3119.1kJ•mol-1 , 则O2比O3稳定
2NH3(g) △H = -38.6kJ•mol-1
D . 已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2Al2O3(s) △H = -2834.9kJ•mol-1 , 4Al(s) + 2O3(g) ═ 2Al2O3(s) △H = -3119.1kJ•mol-1 , 则O2比O3稳定
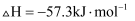 ,则
,则  和
和 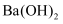 反应的中和热
反应的中和热 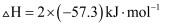 B .
B . 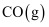 的燃烧热是
的燃烧热是 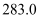
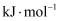 ,则
,则 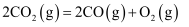 反应的
反应的 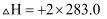
 C . 需要加热才能发生的反应一定是吸热反应
D . 乙烷的燃烧热就是1mol乙烷燃烧生成气态水和二氧化碳所放出的热量
C . 需要加热才能发生的反应一定是吸热反应
D . 乙烷的燃烧热就是1mol乙烷燃烧生成气态水和二氧化碳所放出的热量
 C(金刚石)△H=+1.9 kJ/mol”可知金刚石比石墨稳定
B . 在101KPa时,1mol碳燃烧所放出的热量为碳的燃烧热
C . 相同的条件下,如果1 mol氢原子所具有的能量为E1 , 1 mol氢分子的能量为E2 , 则2E1﹥E2
D . HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4 和Ca(OH)2 反应的中和热为△H=-(2×57.3)kJ/mol
C(金刚石)△H=+1.9 kJ/mol”可知金刚石比石墨稳定
B . 在101KPa时,1mol碳燃烧所放出的热量为碳的燃烧热
C . 相同的条件下,如果1 mol氢原子所具有的能量为E1 , 1 mol氢分子的能量为E2 , 则2E1﹥E2
D . HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4 和Ca(OH)2 反应的中和热为△H=-(2×57.3)kJ/mol

过程Ⅰ:……
过程Ⅱ:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=+129.2 kJ·mol﹣1
下列说法正确的是( )
 O2(g) ΔH=﹣156.6 kJ·mol﹣1
C . 氢气的摩尔燃烧焓为ΔH=﹣285.8 kJ·mol﹣1
D . 铁氧化合物循环制H2具有成本低、产物易分离等优点
O2(g) ΔH=﹣156.6 kJ·mol﹣1
C . 氢气的摩尔燃烧焓为ΔH=﹣285.8 kJ·mol﹣1
D . 铁氧化合物循环制H2具有成本低、产物易分离等优点

已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:
-
(1) 图中A、C分别表示、,E的大小对该反应的反应热(填“有”或“无”)影响;
-
(2) 该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是;
-
(3) 图中ΔH=kJ·mol-1;
-
(4) 已知单质硫的燃烧热ΔH=-296 kJ·mol-1 , 计算由S(s)生成1 mol SO3(g)的ΔH(写出计算过程)。
-
(1) 用离子方程式表示 NH4Cl 溶液显示酸性的原因:。
-
(2) 有机物 M 经过太阳光光照可转化成 N,转化过程如下:

则 M、N 相比,较稳定的是。
-
(3) 已知在常温常压下:
①2CH3 OH(l)+3O 2 (g) =2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式。
-
(1) 氢气是一种环保的气体,不会污染大气且热值高。相关化学键的键能表示如表:
化学键
O=O
H—H
O—H
键能E/(kJ·mol-1)
a
b
c
则氢气燃烧热的△H=kJ/mol(用含a、b、c代数式表示)
-
(2) 催化制氢是目前大规模制取氢气的方法之一:CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1。在T1℃时,将0.10molCO与0.40molH2O充入5L的容器中,反应平衡后H2的物质的量分数x(H2)=0.08。
CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1。在T1℃时,将0.10molCO与0.40molH2O充入5L的容器中,反应平衡后H2的物质的量分数x(H2)=0.08。①反应平衡常数K=。(结果保留2位有效数字)
②保持K不变,提高CO平衡转化率措施有:。(任意一条)
③由T1℃时上述实验数据计算得到v正~x(CO)和v逆~x(H2)的关系可用如图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为。(填字母)
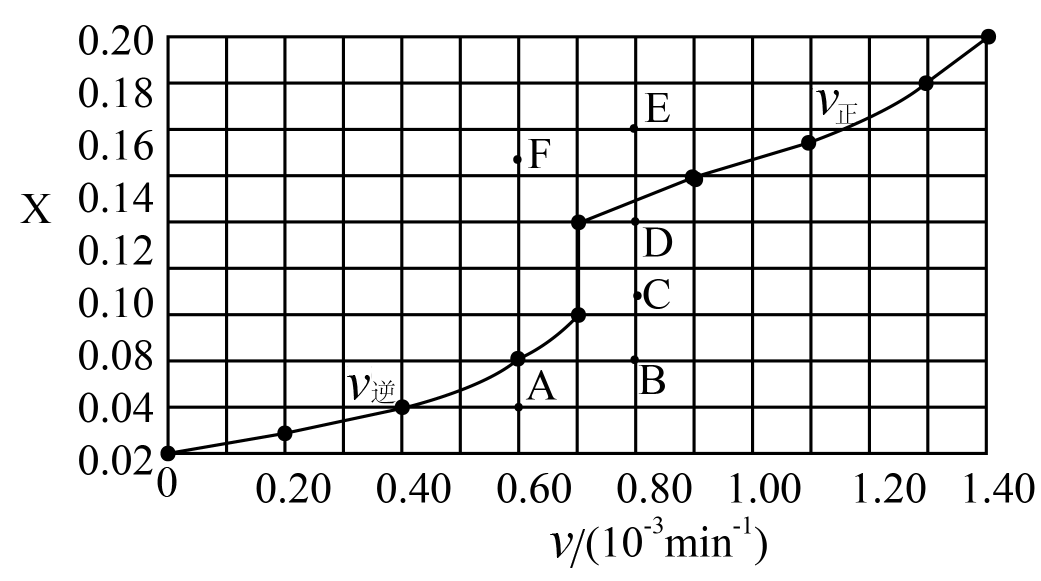
④研究表明,CO催化变换反应的速率方程为:v=k[x(CO)•x(H2O)-
 ],式中,x(CO)、x(H2O)、x(CO2)、x(H2)分别表示相应的物质的量分数,KP为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,CO催化变换反应的KP(填“增大”或“减小”或“不变”)。根据速率方程分析,T>Tm时v逐渐减小的原因是。
],式中,x(CO)、x(H2O)、x(CO2)、x(H2)分别表示相应的物质的量分数,KP为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,CO催化变换反应的KP(填“增大”或“减小”或“不变”)。根据速率方程分析,T>Tm时v逐渐减小的原因是。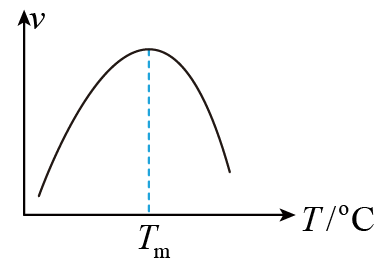
-
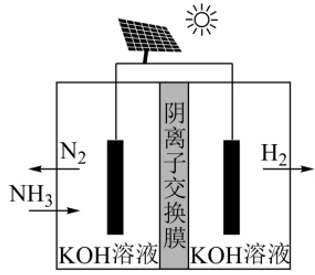
(3) 氨电解法制氢气
利用电解原理,将氨转化为高纯氢气,其装置如图所示。阳极的电极反应式为。

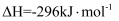 B .
B . 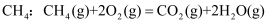
 C .
C . 
 D .
D .