燃烧热 知识点题库
-
(1) 下列△H表示物质燃烧热的是;表示物质中和热的是 .
A.2H2(g)+O2(g)=2H2O(l);△H1
B.C(s)+
 O2(g)=CO(g);△H2
O2(g)=CO(g);△H2C.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H3
D.C(s)+O2(g)=CO2(g);△H4
E.C6H12O6(s)+12O2(g)=6CO2 (g)+6H2O (l);△H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l);△H7
H.CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H8
-
(2) 甲硅烷(SiH4)是一种无色液体,遇到空气能发生爆炸性自燃,生成SiO2和水.已知室温下10g甲硅烷自燃放出热量446kJ,表示其燃烧热的热化学方程式为 .
-
(3) 使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1molCl2参与反应时释放145kJ的热量,写出这个热化学方程式:.
 O2(g)△H=+242 kJ•mol﹣1
B . 2H2(g)+O2(g)═2H2O(l)△H=﹣484 kJ•mol﹣1
C . H2(g)+
O2(g)△H=+242 kJ•mol﹣1
B . 2H2(g)+O2(g)═2H2O(l)△H=﹣484 kJ•mol﹣1
C . H2(g)+ O2(g)═H2O(g)△H=﹣242 kJ•mol﹣1
D . H2(g)+
O2(g)═H2O(g)△H=﹣242 kJ•mol﹣1
D . H2(g)+ O2(g)═H2O(l)△H=﹣242 kJ•mol﹣1
O2(g)═H2O(l)△H=﹣242 kJ•mol﹣1
请运用化学反应原理的相关知识研究元素及其化合物的性质.
(1)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)⇌CH3OH(g)△H1=﹣116KJ•mol﹣1
又知:CO(g)+ O2(g)═CO2(g)△H2=﹣283KJ•mol﹣1
O2(g)═CO2(g)△H2=﹣283KJ•mol﹣1
H2(g)+ O2(g)═H2O(g)△H3=﹣242KJ•mol﹣1
O2(g)═H2O(g)△H3=﹣242KJ•mol﹣1
H2(g)+ O2(g)═H2O(g)△H4=﹣286KJ•mol﹣1
O2(g)═H2O(g)△H4=﹣286KJ•mol﹣1
则甲醇的燃烧热为 .
(2)T℃时,向2L密闭容器中充入4mol CO和6mol H2 , 5min后达平衡时CH3OH物质的量为2mol.该反应的速率v(H2)为 ;下列措施中有利于增大该反应的反应速率且提高转化率的是 .
a.随时将CH3OH与反应混合物分离
b.降低反应温度
c.使用高效催化剂
d.增大体系压强
(3)在密闭容器中充有10mol CO与20mol H2 , 在催化剂作用下反应生成甲醇,CO的转化率(a)与温度(T)、压强(P)的关系如图所示.
①A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间,tA tc(填“大于”、“小于’’或“等于“).
②若A点时容器的体积为10L,该温度下B点的平衡常数K= .
(4)Na2SO3的水溶液呈 (填“酸”、“中”、‘‘碱”)性,原因是(用离子方程式表示): ;把CaCO3浊液滴入l.0mol/L的Na2SO3溶液中,能否产生CaSO3沉淀?若不能,说明原因;若可行,请简述判断依据及转化过程
(已知:Ksp(CaSO3)=1.4×10﹣7 , Ksp(CaCO3)=2.8×10﹣9).

①CaCO3(s)═CaO+CO2(g)△H=+177.7kJ
②C(s)+H2O(s)═CO(g)+H2(g)△H=﹣131.3kJ•mol﹣1
③  H2SO4(1)+NaOH(1)═
H2SO4(1)+NaOH(1)═  Na2SO4(1)+H2O(1)△H=﹣57.3kJ•mol﹣1
Na2SO4(1)+H2O(1)△H=﹣57.3kJ•mol﹣1
④C(s)+O2(g)═CO2(g)△H=﹣393.5kJ•mol﹣1
⑤CO(g)+  O2(g)═CO2(g)△H=﹣283kJ•mol﹣1
O2(g)═CO2(g)△H=﹣283kJ•mol﹣1
⑥HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(1)△H=﹣57.3kJ•mol﹣1
⑦2H2(g)+O2(g)═2H2O(1)△H=﹣517.6kJ•mol﹣1
-
(1) 上述热化学方程式中,不正确的有,不正确的理由分别是.
-
(2) 根据上述信息,写出C转化为CO的热化学方程式:.
-
(3) 上述反应中,表示燃烧热的热化学方程式有;表示中和热的热化学方程式有
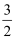 O2(g)=2H2O(l)+CO(g)△H1
B . S(s)+
O2(g)=2H2O(l)+CO(g)△H1
B . S(s)+ 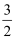 O2(g)=SO3(s)△H2
C . C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H3
D . 2CO(g)+O2(g)=2CO2(g)△H4
O2(g)=SO3(s)△H2
C . C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H3
D . 2CO(g)+O2(g)=2CO2(g)△H4
 2NH3(g) ΔH=-38.6 kJ·mol-1
C . HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1 , 则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D . 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C . HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1 , 则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D . 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1

②H2(g)+1/2O2(g) = H2O(l) ΔH2=-285.8 kJ·mol-1。
气态分子中的化学键 | 断开1 mol化学键所需的能量/kJ |
O—H | 465 |
O | 498 |
下列说法错误的是( )
-
(1) 已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为。
-
(2) 已知碳的燃烧热ΔH1= a kJ·mol-1 , S(s)+2K(s)=K2S(s);ΔH2= b kJ·mol-12K(s)+N2(g)+3O2(g)=2KNO3(s) ΔH3= c kJ·mol-1 , 则S(s)+2KNO3(s)+3C(s)=K2S(s)
+N2(g)+3CO2(g) ΔH=。
-
(3) 已知:C(s)+O2(g)=CO2(g) ΔH=-437.3 kJ·mol一1 , H2(g)+1/2O2(g)=H2O(g) ΔH=-285.8 kJ·mol一1 , CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ·mol一1 , 写出煤气化(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式,计算10m3(标况)水煤气完全燃烧放出的热量为kJ(结果保留到小数点后一位)。
-
(1) 在25℃101kPa时,CO在1molO2中恰好完全燃烧,放出851.6kJ的热量。则CO燃烧的热化学方程式为。
-
(2) 同素异形体在一定条件下可以相互转化。已知:
白磷燃烧:P4(s)+5O2(g)=P4O10(s) △H=-2983.2kJ/mol
红磷燃烧:P(s)+
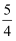 O2(g)=
O2(g)= 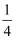 P4O10(s) △H=-738.5kJ/mol
P4O10(s) △H=-738.5kJ/mol则相同状况下,能量状态较低的是;白磷的稳定性比红磷(填“高”或“低”),写出白磷转化为红磷的热化学方程式为。
-
(3) 已知CH4的燃烧热为akJ/mol,断裂1molO=O键时吸收热量bkJ,形成1molH—O键时放出热量ckJ,形成1molC=O键时放出热量dkJ,则C—H键断裂时吸收热量为(用abcd表示)。
| 燃料 | 一氧化碳 | 甲烷 | 异辛烷(C8H18) | 乙醇 |
| ΔH | -283.0 kJ • mol-1 | -891.0 kJ • mol-1 | -5461.0 kJ • mol-1 | -1366.8 kJ • mol-1 |
使用上述燃料最能体现“低碳经济”理念的是
-
(1) CH4用NiO作载氧体的化学链燃烧示意图如下:

主要热化学反应如下:
I.2Ni(s)+O2(g)=2NiO(s) ∆H=-479.8kJ∙mol-1
II.CH4(g)+4NiO(s)=CO2(g)+2H2O(l)+4Ni(s) ∆H=+68.9kJ∙mol-1
①CH4的燃烧热是。
②与直接燃烧CH4相比“化学链燃烧”的优点为。
a.燃烧等质量的CH4 , 放出的热量多
b.有利用于二氧化碳的分离与回收
c.燃烧等质量的CH4 , 消耗的O2少
-
(2) 用FeO作载氧剂部分反应的lgKp与温度的关系如图所示。[已知:平衡常数Kp是用平衡分压(平衡分压=总压x物质的量分数)代替平衡浓度]

①R点对应温度下向某恒容密闭容器中通入1.0molCO和0.2molCO2 , 并加入足量的FeO,只发生反应a:CO(g)+FeO(s)=CO2(g)+Fe(s),则CO的平衡转化率为。
②若某恒容密闭容器中只发生反应b和c,平衡时对应上图中Q处时,容器中气体分压p(X)间应满足的关系是。
-
(3) 在T℃下,向某恒容密闭容器中加入1molCH4(g)和足量的FeO(s)进行反应:CH4(g)+4FeO(s)⇌4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为Po , 达到平衡状态时容器的气体压强是起始压强的2倍。
①T℃下该反应的Kp=。
②其他条件不变,若将该容器改为恒压密闭容器,则此时CH4的平衡转化率(填“增大”“减小”或“不变”)。
-
(4) 利用电解装置可实现CH4和CO2两种分子的耦合转化其原理如图所示。

①写出生成乙烯的电极反应式为:。
②若生成的乙烯和乙烷的体积比为1:2,则消耗的CH4和CO2体积比为。
-
(1) 4.0g硫粉在足量的氧气中完全燃烧生成二氧化硫,放出
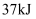 热量,则硫的燃烧热为。
热量,则硫的燃烧热为。
-
(2) 味精的主要成分是谷氨酸形成的钠盐——谷氨酸钠,已知谷氨酸是一种弱酸,则味精溶于水后溶液显性。
-
(3) 泡沫灭火器可以用于扑灭以下物品中的初期着火。
a.金属镁 b.家用电器 c.纸张 d.植物油
-
(4) 炒菜用的铁锅若未及时洗净(残液中含有
 ),便会因腐蚀而出现红褐色锈斑,此条件下铁锅锈蚀时正极的电极反应为。
),便会因腐蚀而出现红褐色锈斑,此条件下铁锅锈蚀时正极的电极反应为。
-
(5) 还原沉淀法是处理工业废水中
 的常用方法,流程如下图所示,其中“转化”步骤时,溶液颜色变化为,“还原”步骤中氧化剂与还原剂的物质的量之比为。
的常用方法,流程如下图所示,其中“转化”步骤时,溶液颜色变化为,“还原”步骤中氧化剂与还原剂的物质的量之比为。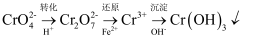
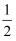 O2(g)
O2(g) H2O(l) ΔH=285.8kJ·mol-1
D . “冰,水为之,而寒于水”说明相同质量的水和冰相比较,水的能量高
H2O(l) ΔH=285.8kJ·mol-1
D . “冰,水为之,而寒于水”说明相同质量的水和冰相比较,水的能量高



