反应热的大小比较 知识点题库
已知合成氨的反应为:N2(g)+3H2(g) 2NH3(g);△H=-QkJ·mo(Q>0)。
2NH3(g);△H=-QkJ·mo(Q>0)。
在同温同压下向密闭容器甲中通入1molN2和3molH2 , 达平衡时,放出的热量为QlkJ;
向另一容积相同的密闭容器乙中通入0.5molN2和1.5 molH2 , 反应达平衡时,放出的热量为Q2kJ。则下列关系式正确的是( )
①C(s)+O2(g)===CO2(g) ΔH1 C(s)+1/2O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3 S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+1/2O2(g)===1/2H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
(2)1mol C与1mol H2O(g)反应生成1mol CO(g)和1mol H2(g),需吸收131.5kJ的热量,该反应的反应热为△H= kJ/mol;
(3)反应A+3B=2C+2D在四种不同情况下的反应速率分别为:
①.v(A)=0.15mol/(L・s) ②.v(B)=0.6mol/(L・s)
③.v(C)=0.4mol/(L・s) ④.v(D)=0.45mol(L・s)
该反应进行快慢的顺序为
(4)火箭发射时可用肼(N2H4)作燃料,二氧化氮作氧化剂,这两者反应生成氮气和水蒸汽.已知:
N2 (g)+2O2 (g)═2NO2 (g)△H=+67.7KJ・mol﹣1
NH3 (g)+O2 (g)═N2 (g)+2H2O(g)△H=﹣534KJ・mol﹣1
则1mol气体肼和NO2完全反应时的反应热△H=
 H2(g)+
H2(g)+  Cl2(g)═HCl(g);△H2
B . 2H2(g)+O2 (g)═2H2O(g);△H1 2H2 (g)+O2 (g)═2H2O(l);△H2
C . CO(g)+
Cl2(g)═HCl(g);△H2
B . 2H2(g)+O2 (g)═2H2O(g);△H1 2H2 (g)+O2 (g)═2H2O(l);△H2
C . CO(g)+  O2(g)═CO2(g);△H1 2CO(g)+O2(g)═2CO2(g);△H2
D . S(s)+O2(g)═SO2 (g);△H1 S(g)+O2(g)═SO2 (g);△H2
O2(g)═CO2(g);△H1 2CO(g)+O2(g)═2CO2(g);△H2
D . S(s)+O2(g)═SO2 (g);△H1 S(g)+O2(g)═SO2 (g);△H2
C(s,金刚石)+O2(g)=CO2(g)△H1
C(s,石墨)+O2(g)=CO2(g)△H2
根据已述反应所得出的结论正确的是( )
①2H2(l)+O2(g)═2H2O(l)△H1=﹣Q1 kJ•mol﹣1
②2H2(g)+O2(g)═2H2O(l)△H1=﹣Q2 kJ•mol﹣1
③2H2(l)+O2(g)═2H2O(g)△H1=﹣Q3 kJ•mol﹣1
则Q1、Q2、Q3的关系表示正确的是( )
A.A(g)+B(g)=C(g)△H1<0 A(g)+B(g)=C(l)△H2<0 则△H1△H2
B.S(g)+O2(g)=SO2(g)△H1<0 S (s)+O2(g)=SO2(g)△H2<0 则△H1△H2
C.C(s)+O2(g)=CO2(g)△H1<0 C(s)+  O2(g)=CO(g)△H2<0 则△H1△H2 .
O2(g)=CO(g)△H2<0 则△H1△H2 .
 O2(g)=CH3CHO(l)+H2O(l) ΔH=-b kJ·mol-1
C . C(s)+
O2(g)=CH3CHO(l)+H2O(l) ΔH=-b kJ·mol-1
C . C(s)+  O2(g)=CO(g) ΔH=-c kJ·mol-1
D . NH3(g)+
O2(g)=CO(g) ΔH=-c kJ·mol-1
D . NH3(g)+  O2(g)=NO(g)+
O2(g)=NO(g)+ 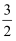 H2O(g) ΔH=-d kJ·mol-1
H2O(g) ΔH=-d kJ·mol-1

回答下列问题:
-
(1) 实验中观察到的现象是。
-
(2) 产生上述现象的原因是。
-
(3) 写出有关反应的离子方程式。
-
(4) 由实验推知,MgCl2溶液和H2的总能量(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
 O2(g)=CO(g) ∆H1;C(s) + O2(g) =CO2(g) ∆H2
B . 2H2(g)+O2(g) =2H2O(g) ∆H1;2H2(g)+O2(g) =2H2O(l) ∆H2
C . S(s) + O2(g) =SO2(g) ∆H1;S(g) + O2(g) =SO2(g) ∆H2
D . NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ∆H1;NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ∆H2
O2(g)=CO(g) ∆H1;C(s) + O2(g) =CO2(g) ∆H2
B . 2H2(g)+O2(g) =2H2O(g) ∆H1;2H2(g)+O2(g) =2H2O(l) ∆H2
C . S(s) + O2(g) =SO2(g) ∆H1;S(g) + O2(g) =SO2(g) ∆H2
D . NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ∆H1;NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ∆H2

 的判断正确的是( )
的判断正确的是( )
 ,
,  B .
B .  C .
C .  D .
D .  ,
, 
I.Cl2(g)→2Cl·(g)
II.CH3CH2CH3(g)+Cl·(g)→ (g)+HCl(g)
(g)+HCl(g)
III. (g)+Cl2(g)→CH3CHClCH3(g)+Cl·(g)
(g)+Cl2(g)→CH3CHClCH3(g)+Cl·(g)
其中,II步反应为决速步骤,能量随反应进程的变化如图,下列说法错误的是( )
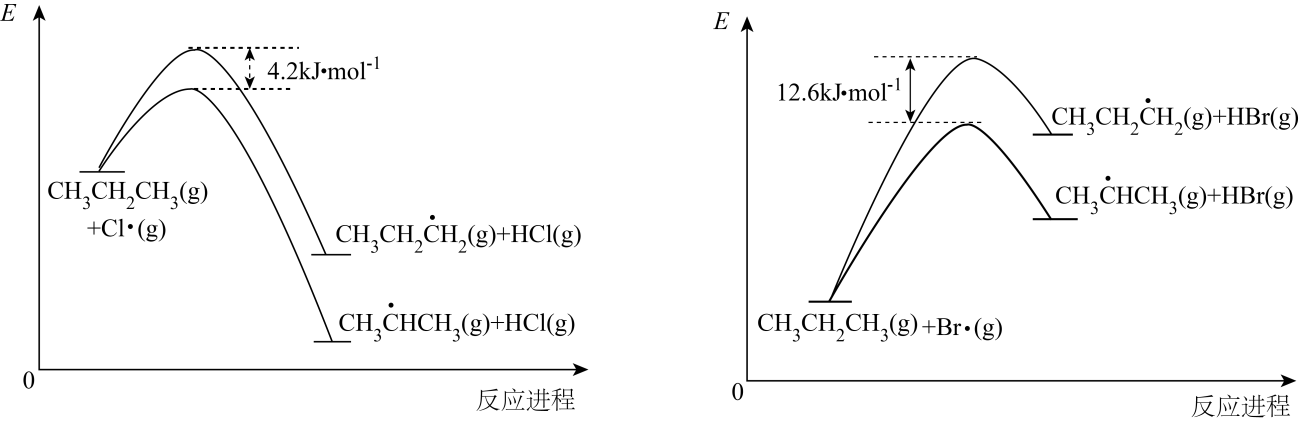
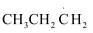 小于
小于 C . 丙烷中不同基团上碳氢键断裂吸收的能量不同
D . 丙烷氯代产物中
C . 丙烷中不同基团上碳氢键断裂吸收的能量不同
D . 丙烷氯代产物中 与溴代产物中
与溴代产物中 近似相等
近似相等
反应Ⅰ: (A)+CH3OH
(A)+CH3OH
 (TAME) ΔH1
(TAME) ΔH1
反应Ⅱ: (B) +CH3OH
(B) +CH3OH
 (TAME) ΔH2
(TAME) ΔH2
反应Ⅲ:

 ΔH3
ΔH3
回答下列问题:
-
(1) 反应Ⅰ、Ⅱ、Ⅲ以物质的量分数表示的平衡常数
 与温度T变化关系如图1所示。
与温度T变化关系如图1所示。
①物质A和B中相对稳定的是(用“A”或“B”表示);
②
 的数值范围是(填标号)。
的数值范围是(填标号)。A.<-1 B.-1~0 C.0~1 D.>1
-
(2) 为研究上述反应体系的平衡关系,向某反应容器中加入
 , 控制温度353K,测得TAME的平衡转化率为α。已知反应Ⅲ的平衡常数
, 控制温度353K,测得TAME的平衡转化率为α。已知反应Ⅲ的平衡常数
①平衡体系中B的物质的量为mol,
②反应Ⅰ的平衡常数
 。
。③同温同压下,再向该容器中注入惰性溶剂四氢呋喃稀释,请判断对反应Ⅰ的化学平衡的影响并说明理由
-
(3) 为研究反应体系的动力学行为,向盛有四氢呋喃的另一容器中加入一定量A、B和
 。控制温度为353K,A、B物质的量浓度c随反应时间t的变化如图2所示。
。控制温度为353K,A、B物质的量浓度c随反应时间t的变化如图2所示。
①代表B的变化曲线为(填“X”或Y”);
②
 时,判断反应Ⅲ的正反应速率
时,判断反应Ⅲ的正反应速率 和逆反应速率
和逆反应速率 的大小并说明理由
的大小并说明理由



