еҸҚеә”зғӯзҡ„еӨ§е°ҸжҜ”иҫғ зҹҘиҜҶзӮ№йўҳеә“
2NH3пјҲgпјү+CO2пјҲgпјүвҮҢCOпјҲNH2пјү2пјҲIпјү+H2OпјҲIпјүв–іHпјҲIпјү
-
пјҲ1пјү е·ІзҹҘеҗҲжҲҗе°ҝзҙ зҡ„еҸҚеә”еҲҶдёӨжӯҘиҝӣиЎҢпјҡ
2NH3пјҲgпјү+CO2пјҲgпјүвҮҢNH2COONH4пјҲsпјүв–іH1
NH2COONH4пјҲsпјүвҮҢCOпјҲNH2пјү2пјҲIпјү+H2OпјҲIпјүв–іH2
е…¶иғҪйҮҸеҸҳеҢ–жӣІзәҝеҰӮеӣҫ1жүҖзӨәпјҢеҲҷв–іHгҖҒв–іH1е’Ңв–іH2з”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸдёәпјҺ

-
пјҲ2пјү еңЁдёҖдёӘзңҹз©әжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯе……е…ҘCO2е’ҢNH3еҸ‘з”ҹеҸҚеә”пјҲIпјүеҗҲжҲҗе°ҝзҙ пјҢжҒ’е®ҡжё©еәҰдёӢж··еҗҲж°”дҪ“дёӯNH3зҡ„дҪ“з§ҜеҲҶж•°еҰӮеӣҫ2жүҖзӨәпјҺ
AзӮ№зҡ„жӯЈеҸҚеә”йҖҹзҺҮvжӯЈпјҲCO2пјү BзӮ№зҡ„йҖҶеҸҚеә”йҖҹзҺҮvйҖҶпјҲCO2пјүпјҲеЎ«вҖңпјһвҖқгҖҒвҖңпјңвҖқжҲ–вҖң=вҖқпјүпјӣCO2зҡ„е№іиЎЎиҪ¬еҢ–зҺҮдёәпјҺ
-
пјҲ3пјү е°ҶдёҖе®ҡйҮҸзҡ„ж°Ёеҹәз”Ій…ёй“өеӣәдҪ“зҪ®дәҺжҒ’е®№зңҹз©әе®№еҷЁдёӯпјҢеҸ‘з”ҹеҸҚеә”пјҡH2NCOONH4пјҲsпјүвҮҢ2NH3пјҲgпјү+CO2пјҲgпјүпјҺеңЁдёҚеҗҢжё©еәҰпјҲT1е’ҢT2пјүдёӢпјҢиҜҘеҸҚеә”иҫҫе№іиЎЎзҠ¶жҖҒж—¶йғЁеҲҶж•°жҚ®и§ҒдёӢиЎЁпјҺ
жё©еәҰ
е№іиЎЎжө“еәҰ/пјҲmolвҖўLп№Ј1пјү
cпјҲNH3пјү
cпјҲCO2пјү
T1
0.1
T2
0.1
в‘ T1T2 пјҲеЎ«вҖңпјһвҖқгҖҒвҖңпјңвҖқжҲ–вҖң=вҖқпјүпјҺ
в‘ЎдёӢеҲ—иғҪиҜҙжҳҺиҜҘеҲҶи§ЈеҸҚеә”иҫҫеҲ°е№іиЎЎзҠ¶жҖҒзҡ„жҳҜпјҲеЎ«д»ЈеҸ·пјүпјҺ
aпјҺvз”ҹжҲҗпјҲNH3пјү=2vж¶ҲиҖ—пјҲCO2пјү
bпјҺеҜҶй—ӯе®№еҷЁеҶ…зү©иҙЁзҡ„жҖ»иҙЁйҮҸдёҚеҸҳ
cпјҺеҜҶй—ӯе®№еҷЁдёӯж··еҗҲж°”дҪ“зҡ„еҜҶеәҰдёҚеҸҳ
dпјҺеҜҶй—ӯе®№еҷЁдёӯж°Ёж°”зҡ„дҪ“з§ҜеҲҶж•°дёҚеҸҳ
-
пјҲ4пјү ж°Ёеҹәз”Ій…ёй“өжһҒжҳ“ж°ҙи§ЈжҲҗзўій…ёй“өпјҢй…ёжҖ§жқЎд»¶дёӢж°ҙи§ЈжӣҙеҪ»еә•.25в„ғж—¶пјҢеҗ‘1L 0.1molвҖўLп№Ј1зҡ„зӣҗй…ёдёӯйҖҗжёҗеҠ е…Ҙж°Ёеҹәз”Ій…ёй“өзІүжң«иҮіжә¶ж¶Іе‘ҲдёӯжҖ§пјҲеҝҪз•Ҙжә¶ж¶ІдҪ“з§ҜеҸҳеҢ–пјүпјҢе…ұз”ЁеҺ»0.052molж°Ёеҹәз”Ій…ёй“өпјҢжӯӨж—¶жә¶ж¶ІдёӯеҮ д№ҺдёҚеҗ«зўіе…ғзҙ пјҺжӯӨж—¶жә¶ж¶ІдёӯcпјҲNH4+пјү=пјӣNH4+ж°ҙи§Је№іиЎЎеёёж•°еҖјдёәпјҺ
в‘ CH4пјҲgпјү+2O2пјҲgпјүв•җCO2пјҲgпјү+2H2OпјҲgпјүпјӣв–іH1=п№ЈQ1 kJвҖўmolп№Ј1
в‘ЎCH4пјҲgпјү+2O2пјҲgпјүв•җCO2пјҲgпјү+2H2OпјҲlпјүпјӣв–іH2=п№ЈQ2 kJвҖўmolп№Ј1 пјҺ
H+пјҲaqпјү+OHп№ЈпјҲaqпјү=H2OпјҲlпјүпјӣв–іH=п№Ј57.3k kJвҖўmolп№Ј1 пјҢ
еҸҲзҹҘпјҡCH3COOHпјҲaqпјү+NaOHпјҲaqпјү=CH3COONaпјҲaqпјү+H2OпјҲlпјүпјӣв–іH=п№ЈQ1kJвҖўmolп№Ј1 пјҢ
 H2SO4пјҲжө“пјү+
H2SO4пјҲжө“пјү+  BaпјҲOHпјү2пјҲaqпјү=
BaпјҲOHпјү2пјҲaqпјү=  BaSO4пјҲaqпјү+H2OпјҲlпјүпјӣв–іH=п№ЈQ2 kJвҖўmolп№Ј1
BaSO4пјҲaqпјү+H2OпјҲlпјүпјӣв–іH=п№ЈQ2 kJвҖўmolп№Ј1
HNO3пјҲaqпјү+KOHпјҲaqпјүв•җKNO3пјҲaqпјү+H2OпјҲlпјүпјӣв–іH=п№ЈQ3 kJвҖўmolп№Ј1 пјҢ
дёҠиҝ°еҸҚеә”еқҮдёәжә¶ж¶Ідёӯзҡ„еҸҚеә”пјҢеҲҷQ1гҖҒQ2гҖҒQ3зҡ„еӨ§е°Ҹе…ізі»жҳҜпјҲВ В пјү


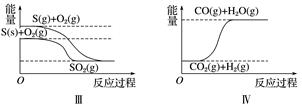
жҚ®жӯӨеҲӨж–ӯдёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜ( )
в‘ҙH2( g )пјӢ  O2( g ) пјқ H2O ( g ) О”H1= a kJ/mol
O2( g ) пјқ H2O ( g ) О”H1= a kJ/mol
в‘ө2H2( g )пјӢO2( g ) пјқ2H2O ( g ) О”H2= b kJ/mol
⑶H2( g )пјӢ  O2 ( g ) пјқ H2O ( l ) О”H3= c kJ/mol
O2 ( g ) пјқ H2O ( l ) О”H3= c kJ/mol
в‘·2H2( g )пјӢO2( g ) пјқ2H2O ( l ) О”H4= dkJ/mol
еҲҷaгҖҒbгҖҒcгҖҒdзҡ„е…ізі»жӯЈзЎ®зҡ„жҳҜпјҲ пјү
в‘ө2H2 (g)пјӢO2 (g)пјқ2H2O(g)пјӣО”H2 = b kJ/mol
⑶ H2 (g)пјӢ1/2O2 (g)пјқH2O(l)пјӣО”H3 = c kJ/mol
в‘· 2H2 (g)пјӢO2 (g)пјқ2H2O(l)пјӣО”H4 = d kJ/mol
еҲҷaгҖҒbгҖҒcгҖҒdзҡ„е…ізі»жӯЈзЎ®зҡ„жҳҜпјҲ пјү
CuSO4В·5H2O (s)= CuSO4(s)+5H2O(1) вҲҶH1
CuSO4(s)= CuSO4(aq) вҲҶH2
CuSO4(aq)= Cu2+(aq)+  (aq) вҲҶH3
(aq) вҲҶH3
CuSO4В·5H2O (s)= Cu2+(aq)+  (aq)+5H2O(1) вҲҶH4
(aq)+5H2O(1) вҲҶH4
P4(зҷҪзЈ·пјҢs)+5O2(g)=2P2O5(s) О”H= -akJВ·mol-1(aпјһ0)пјӣ
4P(зәўзЈ·пјҢs)+5O2(g)=2P2O5(s) О”H=-bkJВ·mol-1(bпјһ0)пјӣ
еҲҷaе’Ңbзҡ„е…ізі»жҳҜпјҲ пјү

 C2H4(g)+H2(g) О”H1=-136kJВ·mol-1
D . CO2(g)+H2(g)
C2H4(g)+H2(g) О”H1=-136kJВ·mol-1
D . CO2(g)+H2(g)  CO(g)+H2O(g) О”H4=41kJВ·molвҲ’1
CO(g)+H2O(g) О”H4=41kJВ·molвҲ’1
-
пјҲ1пјү е·ІзҹҘеңЁ298Kе’Ң101KPaжқЎд»¶дёӢпјҢжңүеҰӮдёӢеҸҚеә”пјҡ
еҸҚеә”в… пјҡC(s)+O2(g)=CO2(g)в–іH1=-393.5kJвҖўmol-1
еҸҚеә”в…Ўпјҡ2C(s)+O2(g)=2CO(g)в–іH2=-221kJвҖўmol-1
еҸҚеә”в…ўпјҡN2(g)+O2(g)=2NO(g)в–іH3=+180.5kJвҖўmol-1
в‘ жұҪиҪҰе°ҫж°”еҮҖеҢ–еҺҹзҗҶдёәеҸҚеә”в…Јпјҡ2NO(g)+2CO(g)вҮҢN2(g)+2CO2(g)пјҢе…¶еҸҚеә”зғӯО”H=пјҢиҜҘеҸҚеә”иғҪиҮӘеҸ‘иҝӣиЎҢзҡ„жқЎд»¶жҳҜ(еЎ«вҖңдҪҺжё©вҖқжҲ–вҖңй«ҳжё©вҖқ)гҖӮ
в‘ЎеңЁжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯеҸ‘з”ҹв…Јзҡ„еҸҚеә”пјҢдёӢеҲ—жңүе…іиҜҘеҸҚеә”зҡ„иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜ(еЎ«еӯ—жҜҚ)гҖӮ
AпјҺеҚҮй«ҳжё©еәҰпјҢе№іиЎЎеёёж•°еҮҸе°Ҹ
BпјҺдҪ“зі»иҫҫеҲ°е№іиЎЎеҗҺпјҢеҠ е…ҘеӮ¬еҢ–еүӮпјҢе№іиЎЎжӯЈеҗ‘移еҠЁ
CпјҺеўһеӨ§
 пјҢе№іиЎЎйҖҶеҗ‘移еҠЁпјҢNOзҡ„иҪ¬еҢ–зҺҮйҷҚдҪҺ
пјҢе№іиЎЎйҖҶеҗ‘移еҠЁпјҢNOзҡ„иҪ¬еҢ–зҺҮйҷҚдҪҺDпјҺе…¶д»–жқЎд»¶дёҚеҸҳпјҢеҗ‘е№іиЎЎдҪ“зі»е……е…ҘCO2ж°”дҪ“пјҢKеҖјеҮҸе°Ҹ
E.иҜҘеҸҚеә”иҝҮзЁӢдёӯпјҢж°”дҪ“зҡ„еҜҶеәҰе§Ӣз»ҲдҝқжҢҒдёҚеҸҳ
-
пјҲ2пјү ж°®зҡ„дёҖз§Қж°ўеҢ–зү©жҳҜHN3 пјҢ е…¶ж°ҙжә¶ж¶Ій…ёжҖ§дёҺйҶӢй…ёзӣёдјјпјҢеёёжё©дёӢпјҢе°Ҷa molВ·L-1зҡ„HN3дёҺb molВ·L-1зҡ„Ba(OH)2жә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲпјҢе……еҲҶеҸҚеә”еҗҺпјҢжә¶ж¶ІдёӯеӯҳеңЁ2c(Ba2+)=c(N
 )пјҢеҲҷиҜҘж··еҗҲзү©жә¶ж¶Іе‘Ҳ(еЎ«вҖңй…ёвҖқвҖңзўұвҖқжҲ–вҖңдёӯвҖқ)жҖ§пјҢж··еҗҲж¶Ідёӯc(HN3)=molВ·L-1гҖӮ
)пјҢеҲҷиҜҘж··еҗҲзү©жә¶ж¶Іе‘Ҳ(еЎ«вҖңй…ёвҖқвҖңзўұвҖқжҲ–вҖңдёӯвҖқ)жҖ§пјҢж··еҗҲж¶Ідёӯc(HN3)=molВ·L-1гҖӮ
-
пјҲ3пјү еҲ©з”Ёз”өи§Јжі•еҸҜд»Ҙж¶ҲйҷӨеәҹж°ҙжә¶ж¶ІдёӯCN- пјҢ е…¶еҺҹзҗҶдёәпјҡзўұжҖ§жқЎд»¶дёӢпјҢйҳіжһҒCl-е…ҲиҪ¬еҢ–дёәClO- пјҢ еҶҚе°ҶCN-ж°§еҢ–дёәдёӨз§Қж— жұЎжҹ“зҡ„ж°”дҪ“гҖӮ
в‘ йҳіжһҒз”өжһҒеҸҚеә”ејҸдёәгҖӮ
в‘ЎйҳіжһҒйҷ„иҝ‘жә¶ж¶ІдёӯйҷӨеҺ»CN-зҡ„зҰ»еӯҗж–№зЁӢејҸдёәгҖӮ

в‘ CO  (aq)+H+(aq)вҮҢHCO
(aq)+H+(aq)вҮҢHCO  (aq) О”H1
(aq) О”H1
в‘ЎHCO  (aq)+H+(aq)вҮҢH2CO3(aq) О”H2
(aq)+H+(aq)вҮҢH2CO3(aq) О”H2
в‘ўH2CO3(aq)вҮҢH2O(l)+CO2(g) О”H3
 (aq)+2I-(aq)=2
(aq)+2I-(aq)=2 (aq)+I2(aq)зҡ„еҸҚеә”иҝӣзЁӢдёӯзҡ„иғҪйҮҸеҸҳеҢ–пјҢеңЁ
(aq)+I2(aq)зҡ„еҸҚеә”иҝӣзЁӢдёӯзҡ„иғҪйҮҸеҸҳеҢ–пјҢеңЁ е’ҢI-зҡ„ж··еҗҲжә¶ж¶ІдёӯеҠ е…ҘFe3+ пјҢ иҝҮзЁӢеҸҠеӣҫеғҸеҰӮдёӢпјҡ
е’ҢI-зҡ„ж··еҗҲжә¶ж¶ІдёӯеҠ е…ҘFe3+ пјҢ иҝҮзЁӢеҸҠеӣҫеғҸеҰӮдёӢпјҡ
жӯҘйӘӨв‘ пјҡ2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq) О”H1
жӯҘйӘӨв‘Ўпјҡ2Fe2+(aq)+ (aq)=2Fe3+(aq)+2
(aq)=2Fe3+(aq)+2 (aq) О”H2
(aq) О”H2
дёӢеҲ—жңүе…іиҜҘеҸҚеә”зҡ„иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲ пјү



