有关反应热的计算 知识点题库
S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=x kJ•mol﹣1
已知:
碳的燃烧热△H1=a kJ•mol﹣1
S(s)+2K(s)═K2S(s)△H2=b kJ•mol﹣1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol﹣1
则x为( )
-
(1) 在催化剂作用下,CH4和水蒸气反应可制得CO和H2 , 已知该反应每制得1g H2 , 吸收34.4kJ热量,写出该反应的热化学方程式.
-
(2) CO可继续与水蒸气反应:CO(g)+H2O(g)=CO2(g)+H2(g)△H=﹣41.0kJ•mol﹣1 . 若将1mol甲烷与足量水蒸气充分反应得到1mol CO2 , 该反应的焓变△H=.
-
(3) 欲制得较纯净的氢气,可将(2)中充分反应后的气体通过足量的烧碱溶液,写出该反应的离子方程式.
①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=﹣26.7kJ•mol﹣1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=﹣50.75kJ•mol﹣1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=﹣36.5kJ•mol﹣1
则反应FeO(s)+CO(g)═Fe(s)+CO2(g)的焓变为( )

下列判断正确的是( )
-
(1) 用Fe2O3作载氧剂的化学链燃烧部分热化学方科式及循环转化的原理如下:
I.C(s)+H2O(g)=CO(g)+H2(g) △H1
II.Fe2O3(s)+
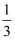 CO(g)=
CO(g)= 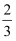 Fe3O4(s)+
Fe3O4(s)+ 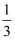 CO2(g) △H2
CO2(g) △H2III.Fe2O3(s)+
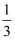 H2(g)=
H2(g)= 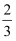 Fe3O4(s)+
Fe3O4(s)+ 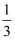 H2O(g) △H3
H2O(g) △H3IV.Fe3O4(s)+
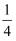 O2(s)=
O2(s)= 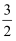 Fe2O3 (s) △H4
Fe2O3 (s) △H4
①在反应器B中进行的反应是(填反应前面的代号);“物质2”是(填化学式)。
②反应C(s)+O2(g)=CO2(g)的△H=(用△H1、△H2、△H3、△H4表示)。
-
(2) 用FeO作载氧剂部分反应的lgKp[Kp是用平衡分压代替平衡浓度(平衡分压=总压×物质的量分数)]与温度的关系如下图所示:

①图中涉及的反应中,属于吸热反应的是(填反应前面的代号)。
②恒容密闭容器中进行反应:CH4(g) +4FeO(s)=4Fe(s) +2H2O(g)+CO2(g),不能说明该反应已达到化学平衡的标志是( 填字母)。
a.v正(CH4)=v正(CO2)
b.气体的压强不再随时间变化
c.气体的密度不再随时间变化
d.单位时间内断裂C-H键与断裂H-O键数目相等
③若某恒容密闭容器中只发生反应I和II,平衡时对应上图中Q 处时,容器中气体分压p(X)间应满足的关系是。
④在某密闭容器中充入0.8 molCO和0.2 mol CO2 并加入足量的FeO,只发生反应I,在R点(lgKp=0),则CO的平衡转化率为。
-
(3) 若用CaSO4作载氧剂进行化学链燃烧时,CaSO4与CO发生反应生成CaS,则反应的化学方程式是。
-
(1) COS的电子式是。
-
(2) 已知热化学方程式:①2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H=-362 kJ·mol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2=-1172 kJ·mol-1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为。
-
(3) 可以用K2CO3溶液吸收H2S,其原理为K2CO3+H2S=KHS+KHCO3 , 该反应的平衡常数为。(已知H2CO3 的Ka1=4.2×10-7 , Ka2=5.6×10-11;H2S的Ka1=5.6×10-8 , Ka2=1.2×10-15)
-
(4) 在强酸溶液中用H2O2 可将COS氧化为硫酸,这一原理可用于COS 的脱硫。该反应反应的化学方程式为。
-
(5) COS的水解反应为COS(g)+H2O(g)
 CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示: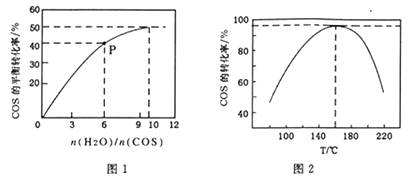
①该反应的最佳条件为:投料比[n(H2O)/n(COS)],温度
②P点对应的平衡常数为 。(保留小数点后2 位)
③当温度升高到一定值后,发现一定时间内COS(g)的水解转化率降低;猜测可能的原因是。
反应Ⅰ:2NH3(g)+CO2(g)  NH2CO2NH4(s) △H1=a kJ·mol-1
NH2CO2NH4(s) △H1=a kJ·mol-1
反应Ⅱ:NH2CO2NH4(s)  CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1
总反应Ⅲ:2NH3(g)+CO2(g)  CO(NH2)2(s)+H2O(g) △H3=-86.98kJ·mol-1
CO(NH2)2(s)+H2O(g) △H3=-86.98kJ·mol-1
请回答下列问题:
-
(1) 反应Ⅰ的△H1= (用具体数据表示)。
-
(2) 反应Ⅱ的△S(填>或<)0,一般在情况下有利于该反应的进行。
-
(3) 反应Ⅲ中影响CO2平衡转化率的因素很多,下图1为某特定条件下,不同水碳比n(H2O)/n(CO2)和温度影响CO2平衡转化率变化的趋势曲线。
①其他条件相同时,为提高CO2的平衡转化率,生产中可以采取的措施是(填提高或降低)水碳比。
②当温度高于190℃后,CO2平衡转化率出现如图所示的变化趋势,其原因是。
-
(4) 某研究小组为探究反应Ⅰ中影响c(CO2)的因素,在恒温下将0.4molNH3和0.2molCO2放入容积为2L的密闭容器中,t1时达到平衡过程中c(CO2)随时间t变化趋势曲线如上图所示。若其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡)。
-
(5) 尿素在土壤中会发生反应CO(NH2)2+2H2O
 (NH4)2CO3。下列物质中与尿素有类似性质的是
A . NH2COONH4 B . H2NOCCH2CH2CONH2 C . HOCH2CH2OH D . HOCH2CH2NH2
(NH4)2CO3。下列物质中与尿素有类似性质的是
A . NH2COONH4 B . H2NOCCH2CH2CONH2 C . HOCH2CH2OH D . HOCH2CH2NH2
化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)  si(s)+4HCl(g),该反应的反应热AH为 ( )
si(s)+4HCl(g),该反应的反应热AH为 ( )
| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
则表中a为( )
-
(1) ab(填“>”、“=”或“ <”)。
-
(2) 下表为不同温度下反应的平衡常数。由此可推知,表中 T1 T2(填“>”、“< ”或“ =”)。
T/K
T1
T2
T3
K
1.00×107
2.54×105
1.88×103
若在原来的容器中,只加入 2 mol C,500 ℃时充分反应达到平衡后,吸收热量 c kJ,则 C 的浓度x mol·L-1(填“>”、“=” 或“ <”),a、
B、c 之间满足何种关系?(用代数式表示)
-
(3) 在相同条件下要想得到 2a kJ 热量,加入各物质的物质的量可能是_____(填字母)。
A . 4 mol A 和 2 mol B B . 4 mol A、 2 mol B 和 2 mol C C . 4 mol A 和 4 mol B D . 6 mol A 和 4 mol B -
(4) 能使该反应的反应速率增大,且平衡向正反应方向移动的是_____(填字母)。A . 及时分离出C 气体 B . 适当升高温度 C . 增大 B 的浓度 D . 选择高效的催化剂
-
(5) 若将上述容器改为恒压容器(反应前体积相同),起始时加入 2 mol A 和 1molB,500 ℃时充分反应达到平衡后,放出热量 d kJ,则 db(填“>”、“=” 或“ <”),理由是。
-
(6) 在一定温度下,在一个容积不变的容器中通入 2 mol A 和 1 mol B 及适量固体催化剂,使反应达到平衡。保持同一反应温度,在相同容器中,将起始物质改为 4 mol A 和 2 mol B,则平衡时A 的转化率(填“不变”、“变大”、“变小”或“不能确定”)。
 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
 2AB(g)的能量变化如图所示,下列叙述中正确的是 ( )
2AB(g)的能量变化如图所示,下列叙述中正确的是 ( ) 
 , 反应产物中的S实为
, 反应产物中的S实为 , 它是一个八元环状分子(即
, 它是一个八元环状分子(即 ),
), 中可看成含2个
中可看成含2个 键。部分共价键键能的数据如下:
键。部分共价键键能的数据如下: :
: ;
; :
: ;
; :
: ;
; :
: 。则a为( )
。则a为( )
 B .
B .  C .
C .  D .
D . 
-
(1) 早期,工业上用热钾碱(K2CO3)溶液吸收烟气中的CO2。该反应在加压下进行的目的是。
-
(2) 1972年,Fox利用C2H6(g)+CO2(g)→C2H4(g)+H2O(g)+CO(g) ΔH,将CO2转化为C2H4。
①上述反应的能量变化如图所示,则ΔH=kJ·mol-1。

②某温度下,等物质的量的C2H6和CO2在刚性容器内发生上述反应,tmin时达到平衡。已知起始总压为akPa,平衡时总压为bkPa,0~tmin的平均反应速率为v(CO2)=kPa·min-1 , 该反应的平衡常数Kp=(用含a、b的代数式表示),欲提高CO2的平衡转化率,可采取的措施有(填标号)。
A.通入惰性气体 B.增加C2H6浓度 C.增加CO2浓度 D.降低温度
③2000年,我国学者研究CeO2催化上述反应的过程为:
(i)2CeO2+C2H6=Ce2O3+C2H4+H2O
(ii)(写出化学方程式)。
-
(3) 2020年,我国学者利用电化学装置将CO2高效转化为C2H4和C2H5OH,其原理如图所示:

①阳极的电极反应式为。
②标准状况下,若消耗2.24LCO2 , 转移电子个数为。






则液体酒精的燃烧热为( )
 B .
B .  C .
C .  D .
D . 



