化学反应速率和化学计量数的关系 知识点题库
在2CH4+2NH3+3O2=2HCN+6H2O反应中,同一时间内测得v(O2)为b mol·L-1·min-1 , v(HCN)为a mol·L-1·min-1 , 则a与b的关系为( )
A . b =1/2 a
B . b =2/3 a
C . b =3/2 a
D . b =2 a
在反应A(g)+3B(g)═2C(g)中,若以物质A表示化学反应速率为0.2mol/(L•min),则以物质B表示此反应的化学反应速率为 mol/(L•min)
已知分解1mol H2O2放出热量98kJ,在含少量I﹣的溶液中,H2O2分解的机理为:
H2O2+I﹣→H2O+IO﹣ 慢
H2O2+IO﹣→H2O+O2+I﹣ 快
下列有关该反应的说法正确的是( )
A . 反应速率与I﹣的浓度有关
B . IO﹣也是该反应的催化剂
C . 反应活化能等于98kJ•mol﹣1
D . v(H2O2)=v(H2O)=v(O2)
把下列四种X溶液分别加入四个盛有10mL 2mol/L盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A . 10℃20mL 3mol/L的X溶液
B . 20℃30mL 2mol/L的X溶液
C . 20℃10mL 4mol/L的X溶液
D . 10℃10mL 2mol/L的X溶液
对于A2+3B2=2C+2D反应,以下化学反应速率的表示中,速率最快的是( )
A . v(B2)=0.8 mol/(L•s)
B . v(A2)=0.4 mol/(L•s)
C . v(C)=0.6 mol/(L•s)
D . v(D)=0.7 mol/(L•s)
向体积为2L的容器中加入1mol N2和6mol H2 , 合成氨.2秒钟之后达到平衡,测得氮气为0.6mol.则氢气的反应速率是( )
A . 0.1mol/(L•s)
B . 0.2mol/(L•s)
C . 0.3mol/(L•s)
D . 0.6mol/(L•s)
某温度时,在一体积不变的容器中充入A、B各1 mol,反应进行到10 s时,测得容器中含有A:0.8 mol;B:0.4 mol;C:0.4 mol。据此回答该反应的化学方程式为:( )
A . A+3B=C
B . 2A+B=C
C . A+3B=2C
D . A+3B=3C
在化学反应A(g)+3B(g)  2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是( )
2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是( )
 2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是( )
2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是( )
A . v(A)=v(B)
B . v(A)=2v(C)
C . 3v(B)=v(C)
D . v(B)=3v(D)
对于A2+3B2  2C的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
A . v(A2)=0.4mol·L-1·s-1
B . v(B2)=0.8mol·L-1·s-1
C . v(C)=0.6mol·L-1·s-1
D . v(B2)=4.2mol·L-1·min-1
在2A+B  3C+4D反应中,表示该反应速率最快的是( )
3C+4D反应中,表示该反应速率最快的是( )
 3C+4D反应中,表示该反应速率最快的是( )
3C+4D反应中,表示该反应速率最快的是( )
A . vA=0.5mol/(L∙s)
B . vB=0.3mol/(L∙s)
C . vC=0.8mol/(L∙s)
D . vD=1mol/(L∙s)
在一定条件下,反应N2+3H2  2NH3 , 在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )
2NH3 , 在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )
 2NH3 , 在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )
2NH3 , 在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )
A . V(NH3)=0.02mol/(L·min)
B . V(N2)=0.005mol/(L·min)
C . V(NH3)=0.17mol/(L·min)
D . V(H2)=0.03mol/(L·min)
汽车尾气中含有CO、NO等有害气体,某新型催化剂能促使NO、CO转化为2种无毒气体。T℃时,将0.8 mol NO和0.8 mol CO充入容积为2 L的密闭容器中,模拟尾气转化,容器中NO物质的量随时间变化如图。

-
(1) 将NO、CO转化为2种无毒气体的化学方程式是。
-
(2) 反应开始至10 min,v(NO)=mol/(L•min)。
-
(3) 下列说法正确的是。
a.新型催化剂可以加快NO、CO的转化
b.该反应进行到10 min时达到化学平衡状态
c.平衡时CO的浓度是0.4 mol/ L
一定温度下,在三个体积均为 1.0 L 的恒容密闭容器中发生反应:2CH3OH(g)  CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g) 
下列说法正确的是( )
A . 该反应的正反应为吸热反应
B . 达到平衡时,容器Ⅰ中的 CH3OH 体积分数比容器Ⅱ中的小
C . 容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长
D . 若起始时向容器Ⅰ中充入 CH3OH 0.15 mol、CH3OCH3 0.15 mol 和 H2O 0.10 mol,则反应将 向正反应方向进行
某化学反应2A(g)  B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
 B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表: | 实验序号 | 0min | 10 min | 20 min | 30 min | 40 min | 50 min | 60 min | |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
-
(1) 在实验1,反应在10至20分钟时间内用A表示表示该反应的平均速率为mol/(L·min)。
-
(2) 在实验2,A的初始浓度c2=mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是。
-
(3) 设实验3的反应速率为v3 , 实验1的反应速率为v1 , 则v3v1(填>、=、<),且c31.0 mol/L(填>、=、<)。
-
(4) 比较实验4和实验1,可推测该反应是反应(选填吸热、放热),理由是
在一个密闭容器中盛有N2和H2 , 它们的起始浓度分别是1.8 mol /L和5.4 mol /L,在一定的条件下它们反应生成NH3 , 10 min后测得N2的浓度是0.8 mol /L,则在这10 min内用NH3来表示的平均反应速率是( )
A . 0.1 mol /(L·min)
B . 0.2 mol /(L·min)
C . 0.3 mol /(L·min)
D . 0.6 mol /(L·min)
将1molX和3molY加入2L的恒容密闭容器中,在一定条件下发生如下反应:X(g)+3Y(s)  Z(g)ΔH=-akJ·mol-1 , 10min后测得Y的物质的量为2.4mol。下列说法正确的是( )
Z(g)ΔH=-akJ·mol-1 , 10min后测得Y的物质的量为2.4mol。下列说法正确的是( )
 Z(g)ΔH=-akJ·mol-1 , 10min后测得Y的物质的量为2.4mol。下列说法正确的是( )
Z(g)ΔH=-akJ·mol-1 , 10min后测得Y的物质的量为2.4mol。下列说法正确的是( )
A . 10min内,Y的平均反应速率为0.03mol·L-1·min-1
B . 第10min时,X的反应速率为0.01mol·L-1·min-1
C . 充分反应后,放出的热量为akJ
D . 混合气体的平均相对分子质量不变,反应达到化学平衡状态
可逆反应 在不同条件下的反应速率如下,其中反应速率最快的是( )
在不同条件下的反应速率如下,其中反应速率最快的是( )
 在不同条件下的反应速率如下,其中反应速率最快的是( )
在不同条件下的反应速率如下,其中反应速率最快的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
某温度时,浓度都是1 mol·L-1的两种气体X2和Y2 , 在密闭容器中发生可逆反应生成气体Z,充分反应后X2的浓度为0.4 mol·L-1 , Y2的浓度为0.8 mol·L-1 , 生成的Z的浓度为0.4 mol·L-1 , 则该反应(Z用X、Y表示)是( )
A . X2+2Y2 2XY2
B . 2X2+Y2
2XY2
B . 2X2+Y2 2X2Y
C . X2+3Y2
2X2Y
C . X2+3Y2 2XY3
D . 3X2+Y2
2XY3
D . 3X2+Y2 2X3Y
2X3Y
 2XY2
B . 2X2+Y2
2XY2
B . 2X2+Y2 2X2Y
C . X2+3Y2
2X2Y
C . X2+3Y2 2XY3
D . 3X2+Y2
2XY3
D . 3X2+Y2 2X3Y
2X3Y
取50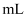 过氧化氢水溶液,在少量
过氧化氢水溶液,在少量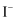 存在下分解:
存在下分解: 。在一定温度下,测得
。在一定温度下,测得 的放出量,转换成
的放出量,转换成 浓度(c)如下表:
浓度(c)如下表:
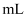 过氧化氢水溶液,在少量
过氧化氢水溶液,在少量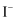 存在下分解:
存在下分解: 。在一定温度下,测得
。在一定温度下,测得 的放出量,转换成
的放出量,转换成 浓度(c)如下表:
浓度(c)如下表:
| 0 | 20 | 40 | 60 | 80 |
| 0.80 | 0.40 | 0.20 | 0.10 | 0.0050 |
下列说法正确的是( )
A . 催化剂可以减少反应热量的放出
B . 反应20 时,测得
时,测得 体积为224L(标准状况)
C . 20~40
体积为224L(标准状况)
C . 20~40 , 消耗
, 消耗 的平均速率为0.010
的平均速率为0.010 D . 第30
D . 第30 时的瞬时速率小于第50
时的瞬时速率小于第50 时的瞬时速率
时的瞬时速率
 时,测得
时,测得 体积为224L(标准状况)
C . 20~40
体积为224L(标准状况)
C . 20~40 , 消耗
, 消耗 的平均速率为0.010
的平均速率为0.010 D . 第30
D . 第30 时的瞬时速率小于第50
时的瞬时速率小于第50 时的瞬时速率
时的瞬时速率
将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g) xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率
xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率 , 下列说法正确的是( )
, 下列说法正确的是( )
 xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率
xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率 , 下列说法正确的是( )
, 下列说法正确的是( )
A . 反应速率 B . 该反应方程式中,x=2
C . 2min时,A的物质的量为1.5mol
D . 2min时,A的转化率为60%
B . 该反应方程式中,x=2
C . 2min时,A的物质的量为1.5mol
D . 2min时,A的转化率为60%
 B . 该反应方程式中,x=2
C . 2min时,A的物质的量为1.5mol
D . 2min时,A的转化率为60%
B . 该反应方程式中,x=2
C . 2min时,A的物质的量为1.5mol
D . 2min时,A的转化率为60%
最近更新





