化学反应速率和化学计量数的关系 知识点题库
某温度下,浓度都是1 mol/L的两种气体X2和Y2 , 在密闭容器中反应生成Z,反应2min后,测得参加反应的X2为0.6mol/L,用Y2变化表示的反应速率v(Y2)= 0.1mol/(L·min),生成的c(Z)=0.4 mol/L,则该反应方程式为( )
A . X2+2 Y2 2XY2
B . 2X2+Y2
2XY2
B . 2X2+Y2 2X2Y
C . 3X2+Y2
2X2Y
C . 3X2+Y2 2X3Y
D . X2+3Y2
2X3Y
D . X2+3Y2 2XY3
2XY3
 2XY2
B . 2X2+Y2
2XY2
B . 2X2+Y2 2X2Y
C . 3X2+Y2
2X2Y
C . 3X2+Y2 2X3Y
D . X2+3Y2
2X3Y
D . X2+3Y2 2XY3
2XY3
在四个不同的容器中,在不同条件下进行合成氨的反应,根据下列在相同时间内测定的结果判断生成氨的速率最快的是( )
A . v(H2)=0.1 mol/(L•min)
B . v(N2)=0.1 mol/(L•min)
C . v(N2)=0.2 mol/(L•min)
D . v(NH3)=0.3 mol/(L•min)
在四个不同的容器中,在不同的条件下进行合成氨反应.根据在相同时间内测定的结果判断,生成氨气的速率最快的是( )
A . v(H2)=0.3 mol•L﹣1•min﹣1
B . v(N2)=0.2 mol•L﹣1•min﹣1
C . v(NH3)=0.25 mol•L﹣1•min﹣1
D . v(H2)=0.4 mol•L﹣1•min﹣1
在某一化学反应中,反应物A的浓度在20s内从1.0mol/L变为0.2mol/L,则在这20s内以A浓度的变化表示的平均反应速率为( )
A . 0.04 mol/(L•s)
B . 0.04 mol/L
C . 0.08 mol/(L•s)
D . 0.08 mol/L
X、Y、Z三种气体进行下列反应:3X+Y⇌2Z,在三种不同情况下测得的速率值为:
①v(X)=1mol•L﹣1•s﹣1;
②v(Y)=0.5mol•L﹣1•s﹣1;
③v(Z)=0.5mol•L﹣1•s﹣1 .
这三种情况下反应的速率大小情况为( )
A . ③>②>①
B . ②>①>③
C . ①>②>③
D . ③>①>②
在2A+B⇌3C+4D反应中,表示该反应速率最快的是( )
A . v(A)=0.5 mol/(L•s)
B . v(B)=0.3mol/(L•s)
C . v(C)=0.6 mol/(L•s)
D . v(D)=1 mol/(L•s)
反应4NH3+5O2  4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是( )
4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是( )
 4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是( )
4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是( )
A . v(O2)=0.125mol·(L·s)-1
B . v(NO)=0.01mol·(L·s)-1
C . v(NH3)=0.01 mol·(L·s)-1
D . v(NH3)=0.2 mol·(L·s)-1
某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:

-
(1) 该反应的化学方程式为;
-
(2) 反应开始至2min,以气体Z表示的平均反应速率为;
-
(3) 混合气体的平均相对分子质量比起始时;(填“大”,“小”或“相等”)
平衡时容器内混合气体密度比起始时(填“大”,“小”或“相等”)
-
(4) 将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=.
在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是( )
A . v(H2)=0.3 mol·L-1·min-1
B . v(N2)=0.05 mol·L-1·s-1
C . v(N2)=0.2 mol·L-1·min-1
D . v(NH3)=0.3 mol·L-1·min-1
在密闭容器里,A与B反应生成C,其反应速率分别用 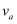 、
、  、
、  表示,已知2
表示,已知2  =3
=3 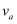 、3
、3  =2
=2  ,则此反应可表示为( )
,则此反应可表示为( )
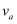 、
、  、
、  表示,已知2
表示,已知2  =3
=3 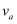 、3
、3  =2
=2  ,则此反应可表示为( )
,则此反应可表示为( )
A . 2A+3B="2C"
B . A+3B="2C"
C . 3A+B="2C"
D . A+B=C
已知一定温度下,在2L的密闭容器中,合成氨反应N2(g)+3H2(g)  2NH3(g)的各物质数据如下:
2NH3(g)的各物质数据如下:
 2NH3(g)的各物质数据如下:
2NH3(g)的各物质数据如下: | N2 | H2 | NH3 | |
| 起始时各物质的物质的量/mol | 2.0 | 6.0 | 0 |
| 2s末各物质的物质的量/mol | 1.2 | 3.6 | 1.6 |
以氢气来表示该化学反应的反应速率为( )
A . 0.2mol·L-1·s-1
B . 0.4mol·L-1·s-1
C . 0.6mol·L-1·s-1
D . 0.8mol·L-1·s-1
在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g)  3C(g)+nD(g),开始时A的物质的量为4 mol,B的物质的量为6 mol;5 min末测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。计算:
3C(g)+nD(g),开始时A的物质的量为4 mol,B的物质的量为6 mol;5 min末测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。计算:
 3C(g)+nD(g),开始时A的物质的量为4 mol,B的物质的量为6 mol;5 min末测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。计算:
3C(g)+nD(g),开始时A的物质的量为4 mol,B的物质的量为6 mol;5 min末测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。计算:
-
(1) 5 min末A的物质的量浓度为。
-
(2) 前5 min内用B表示的化学反应速率v(B)为。
-
(3) 化学方程式中n的值为。
-
(4) 此反应在四种不同情况下的反应速率分别为
①v(A)=5 mol·L-1·min-1 ②v(B)=6 mol·L-1·min-1
③v(C)=4.5 mol·L-1·min-1 ④v(D)=8 mol·L-1·min-1
其中反应速率最快的是(填序号)。
-
(5) 在4 L密闭容器中,X、Y、Z三种气体的物质的量随时间变化曲线如图:

①该反应的化学方程式是。
②该反应达到平衡状态的标志是(填字母)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1 mol Y的同时消耗2 mol Z
③2 min内Y的转化率为。
2A(g)+ 3B(g)=C(g)+ 3D(g)的反应中,表示相同条件下反应速率最快的是( )
A . v(A)=3.5mol·L-1·s-1
B . v(B) =2.4mol·L-1·s-1
C . v(C) =2mol·L-1·s-1
D . v(D) =3mol·L-1·s-1
在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A . v(A)=0.6mol·L-1·s-1
B . v(B)=0.4mol·L-1·s-1
C . v(C)=0.9mol·L-1·s-1
D . v(D)=l.0mol·L-1·s-1
某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如图所示(A,B,C均为气体,且A气体有颜色)。

-
(1) 该反应的的化学方程式为。
-
(2) 反应开始至2分钟时,B的平均反应速率为。
-
(3) 能说明该反应已达到平衡状态的是。
a.v(A)= 2v(B) b.容器内各物质的物质的量相等
c.v逆(A)=v正(C) d.容器内气体的颜色保持不变
-
(4) 由图求得平衡时A的转化率为。
在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是( )
A . v(N2)=0.05 mol·L-1·s-1
B . v(H2)=0.3 mol·L-1·min-1
C . v(N2)=0.2 mol·L-1·min-1
D . v(NH3)=0.3 mol·L-1·min-1
 在不同条件下的反应速率表示如下,其中反应进行最快的是( )
在不同条件下的反应速率表示如下,其中反应进行最快的是( )
A . v(A)=0.01mol/(L·s)
B . v(B)=0.02mol/(L·s)
C . v(B)=0.60mol/(L·min)
D . v(C)=1.00mol/(L·min)
在一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生反应3A(g)+ B(g)  xC(g)+2D(g)。 2 min时该反应达到平衡,测得生成0.4 mol C和0.8 mol D。下列判断正确的是( )
xC(g)+2D(g)。 2 min时该反应达到平衡,测得生成0.4 mol C和0.8 mol D。下列判断正确的是( )
 xC(g)+2D(g)。 2 min时该反应达到平衡,测得生成0.4 mol C和0.8 mol D。下列判断正确的是( )
xC(g)+2D(g)。 2 min时该反应达到平衡,测得生成0.4 mol C和0.8 mol D。下列判断正确的是( )
A . x=2
B . 2 min时,A的浓度为1.2 mol·L-1
C . B的平衡转化率为40%
D . 2 min内A的平均反应速率为0.6 mol· L-1·min-1
已知:3Cl2 +2NH3=N2 +6HCl。若反应速率分别用v(Cl2)、v(NH3) 、v(N2)、v(HCl)表示,则下列关系式正确的是( )
A . 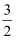 v(Cl2)= v(NH3)
B .
v(Cl2)= v(NH3)
B .  v (Cl2)=v (N2)
C .
v (Cl2)=v (N2)
C . 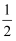 v(Cl2) = v(HCl)
D .
v(Cl2) = v(HCl)
D .  v(NH3)=v(HCl)
v(NH3)=v(HCl)
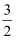 v(Cl2)= v(NH3)
B .
v(Cl2)= v(NH3)
B .  v (Cl2)=v (N2)
C .
v (Cl2)=v (N2)
C . 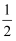 v(Cl2) = v(HCl)
D .
v(Cl2) = v(HCl)
D .  v(NH3)=v(HCl)
v(NH3)=v(HCl)
已知分解1mol H2O2 , 放出热量98 kJ,在含少量I-的溶液中,H2O2分解的机理为①H2O2 + I﹣→ H2O + IO﹣(慢)②H2O2 + IO﹣→ H2O + I﹣+O2↑(快)。下列有关该反应的说法正确的是( )
A . 反应速率与I-的浓度有关
B . 该反应的热化学方程式为2H2O2(l ) = O2(g) + 2H2O(l) △H= 196 kJ/mol
C . IO﹣是该反应的催化剂
D . v(H2O2) = v(O2)
最近更新



