化学反应速率和化学计量数的关系 知识点
化学反应速率和化学计量数的关系:化学反应速率之比等于化学计量数之比,根据反应方程式各物质反应和生成遵从系数比,速率等于变化量除以时间,由于变化量之比等于系数之比,所以速率之比等于系数之比。
化学反应速率和化学计量数的关系 知识点题库
对于可逆反应N2(g)+3H2(g) 2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
A . v(H2)=0.005 mol/(L·s)
B . v(NH3)=0.01 mol/(L·s)
C . v(N2)=0.2 mol/(L·min)
D . v(H2)=0.4 mol/(L·min)
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A)∶c(B) =3∶5,C的平均反应速率为0.1mol/(L·min)。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A)∶c(B) =3∶5,C的平均反应速率为0.1mol/(L·min)。求:
①此时A的浓度c(A) =mol/L,反应开始前容器中的A、B的物质的量:n(A) =n(B) =mol。
②B的平均反应速率:v(B) =mol/(L·min)。
③x的值为。
在体积为2L密闭容器中加入反应物A,B,发生如下反应:A+2B=3C.经2min后,A的浓度从开始时的1.0mol•L﹣1 降到0.8mol•L﹣1 . 已知反应开始时B的浓度是1.2mol•L﹣1 . 则:2min末B的浓度,C的物质的量.2min内,用A物质的浓度变化来表示该反应的反应速率,即V(A)=.
将气体A,B置于容积为2L的密闭容器中,发生反应:4A(g)+B(g)=2C(g)反应进行到4s末,测得C为0.2mol.则该反应速率v(C)为( )
A . 0.025 mol/(L•s)
B . 0.012 5 mol/(L•s)
C . 0.05 mol/(L•s)
D . 0.1 mol/(L•s)
把下列四种X溶液分别加入四个盛有10m L 2mol/L盐酸的烧杯中,均加水稀释到50mL,此时X和盐酸和缓地进行反应.其中反应速率最大的是( )
A . 10℃,20mL 3mol/L的X溶液
B . 50℃20mL 3mol/L的X溶液
C . 50℃10mL 4mol/L的X溶液
D . 10℃10mL 2mol/L的X溶液
汽车尾气处理时发生反应:4CO+2NO2⇌N2+4CO2 . 在不同条件下的化学反应速率不同,下列表示反应速率最慢的是( )
A . v(CO)=0.03mol•L﹣1•s﹣1
B . v(NO2)=0.7mol•L﹣1•min﹣1
C . v(N2)=0.4mol•L﹣1•min﹣1
D . v(CO2)=1.1mol•L﹣1•min﹣1
可逆反应A(g)+3B(g)2C(g)+D(g),在不同条件下的反应速率如下,其中反应速率最快的是( )
A . v(A)=0.5 mol/(L•min)
B . v(B)=0.02mol/(L•s)
C . v(C)=0.8 mol/(L•min)
D . v(D)=0.01mol/(L•s)
将固体NH4Br置于密闭容器中,在某温度下,发生下列反应:NH4Br(s)═NH3(g)+HBr(g),2HBr(g)⇌Br2(g)+H2(g).2min时,测知H2的浓度为0.5mol•L﹣1 , HBr的浓度为4mol•L﹣1 , 若上述反应速率用v(NH3)表示,下列速率正确的是( )
A . 0.5mol•L﹣1•min﹣1
B . 2.5mol•L﹣1•min﹣1
C . 2mol•L﹣1•min﹣1
D . 5mol•L﹣1•min﹣1
反应4NH3(气)+5O2(气)⇌4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率 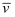 (X)可表示为( )
(X)可表示为( )
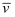 (X)可表示为( )
(X)可表示为( )
A . 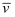 (NH3)=0.0100mol∙L﹣1∙s﹣1
B .
(NH3)=0.0100mol∙L﹣1∙s﹣1
B . 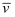 (O2)=0.0010mol∙L﹣1∙s﹣1
C .
(O2)=0.0010mol∙L﹣1∙s﹣1
C . 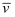 (NO)=0.0010mol∙L﹣1∙s﹣1
D .
(NO)=0.0010mol∙L﹣1∙s﹣1
D . 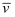 (H2O)=0.045mol∙L﹣1∙s﹣1
(H2O)=0.045mol∙L﹣1∙s﹣1
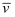 (NH3)=0.0100mol∙L﹣1∙s﹣1
B .
(NH3)=0.0100mol∙L﹣1∙s﹣1
B . 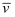 (O2)=0.0010mol∙L﹣1∙s﹣1
C .
(O2)=0.0010mol∙L﹣1∙s﹣1
C . 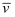 (NO)=0.0010mol∙L﹣1∙s﹣1
D .
(NO)=0.0010mol∙L﹣1∙s﹣1
D . 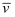 (H2O)=0.045mol∙L﹣1∙s﹣1
(H2O)=0.045mol∙L﹣1∙s﹣1
对于N2+3H2  2NH3 , 下列不同物质表示的反应速率最大的是( )
2NH3 , 下列不同物质表示的反应速率最大的是( )
 2NH3 , 下列不同物质表示的反应速率最大的是( )
2NH3 , 下列不同物质表示的反应速率最大的是( )
A . v(N2)=0.01 mol·L-1· min-1
B . v(H2)=0.06 mol·L-1· min-1
C . v(NH3)=0.02 mol·L-1· min-1
D . v(H2)=0.002 mol·L-1· min-1
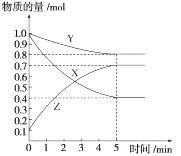
某温度下,在2 L密闭容器中,X、Y、Z三种气态物质发生化学反应时,物质的量随时间变化的关系曲线如图所示:
-
(1) 由图中的数据分析,该反应的化学方程式为。
-
(2) 5 min内用Z表示的平均反应速率为。
-
(3) 化学反应速率受到很多因素的影响,例如:实验室制取氢气时一般用粗锌替代纯锌和稀硫酸反应,这是利用原理加快了氢气生成的速率。
1 molX气体跟amolY气体在体积可变的密闲容器中发生如下反应X( g) +aY(g)=bZ(g),反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是( )
A . a = 2,b = 1
B . a=39,b =2
C . a=2,b = 2
D . a=3,b = 3
在2A(g)+B(g)  3C(g)+4D(g)反应中,下列表示该反应速率最快的是( )
3C(g)+4D(g)反应中,下列表示该反应速率最快的是( )
 3C(g)+4D(g)反应中,下列表示该反应速率最快的是( )
3C(g)+4D(g)反应中,下列表示该反应速率最快的是( )
A . v(A)=0.5 mol/(L·min)
B . v(B)=0.4 mol/(L·min)
C . v(C)=1.5×10-2mol/(L·s)
D . v(D)=1.0mol/(L·min)
2SO2(g)+O2(g)  2SO3(g)的反应中,经过一段时间后,SO3的浓度增加了0.9 mol·L-1 , 此时间内用O2表示的平均速率为0.45 mol·L-1·s-1 , 则这段时间是( )
2SO3(g)的反应中,经过一段时间后,SO3的浓度增加了0.9 mol·L-1 , 此时间内用O2表示的平均速率为0.45 mol·L-1·s-1 , 则这段时间是( )
 2SO3(g)的反应中,经过一段时间后,SO3的浓度增加了0.9 mol·L-1 , 此时间内用O2表示的平均速率为0.45 mol·L-1·s-1 , 则这段时间是( )
2SO3(g)的反应中,经过一段时间后,SO3的浓度增加了0.9 mol·L-1 , 此时间内用O2表示的平均速率为0.45 mol·L-1·s-1 , 则这段时间是( )
A . 1 s
B . 0.44 s
C . 2 s
D . 1.33 s
下列说法正确的是( )
A . 化学反应速率通常用单位时间内反应物或生成物的质量变化来表示
B . 用不同物质的浓度变化表示同一时间内同一反应的速率时,其数值之比等于化学方程式中对应物质的化学计量数之比
C . 化学反应速率表示化学反应在某时刻的瞬时速率
D . 在反应过程中,反应物的浓度逐渐变小,所以用反应物表示的化学反应速率为负值
对于可逆反应A(g)+3B(g)  2C(g)+D(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
2C(g)+D(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
 2C(g)+D(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
2C(g)+D(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A . v(A)=0.1mol·L-1·s-1
B . v(B)=0.6mol·L-1·s-1
C . v(C)=0.9 mol·L-1 min-1
D . υ(D)=1.2mol·L-1·min-1
-
(1) I.如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体的物质的量浓度随时间变化的情况.

试回答下列问题:
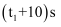 时,B的物质的量分数为,(结果保留一位小数)此时
时,B的物质的量分数为,(结果保留一位小数)此时 
 (填“>”“<”或“=”).
(填“>”“<”或“=”). -
(2) 下列关于该反应的说法正确的是(填序号).
a.到达
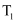 时刻该反应已停止
时刻该反应已停止b.在
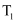 时刻之前,气体B的消耗速率大于它的生成速率
时刻之前,气体B的消耗速率大于它的生成速率c.在
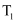 时刻,气体C的正反应速率等于逆反应速率
时刻,气体C的正反应速率等于逆反应速率 -
(3) 容器中
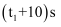 时的压强与起始时的压强之比为.
时的压强与起始时的压强之比为.
-
(4) Ⅱ.合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导.
下列措施能用勒夏特列原理解释是(填序号).
a.增大压强有利于合成氨b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500℃左右d.需要使用过量的
 ,提高
,提高  转化率
转化率 -
(5) 0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,该反应的热化学方程式是.
-
(6) 如图表示合成氨的反应速率(v)随时间(t)变化图像.图中从
 反应物转化率最低的是时刻.
反应物转化率最低的是时刻. 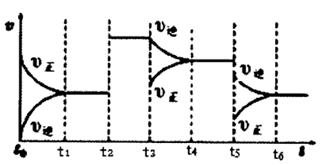 .
.
下列有关化学反应速率的说法中正确的是( )
A . 对任何化学反应来说,反应速率越大,反应现象就越明显
B . 化学反应速率通常用单位时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加来表示
C . 若某化学反应的反应速率为0.5 mol·L-1·s-1 , 就是指在该时间内反应物和生成物的浓度变化都为0.5 mol·L-1·s-1
D . 化学反应速率是用来衡量化学反应进行快慢的物理量
在 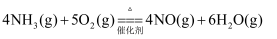 反应中,表示该反应速率最快的是( )
反应中,表示该反应速率最快的是( )
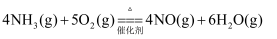 反应中,表示该反应速率最快的是( )
反应中,表示该反应速率最快的是( )
A .  B .
B . 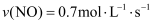 C .
C .  D .
D . 
 B .
B . 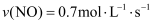 C .
C .  D .
D . 
在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述错误的是(溶液体积变化忽略不计)( )
A . 0~6min的平均反应速率:v(H2O2)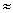
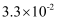 mol/(L·min)
B . 6~10min的平均反应速率:v(H2O2)<
mol/(L·min)
B . 6~10min的平均反应速率:v(H2O2)<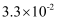 mol/(L·min)
C . 反应至6min时,c(H2O2)=0.3mol/L
D . 反应至6min时,H2O2分解了50%
mol/(L·min)
C . 反应至6min时,c(H2O2)=0.3mol/L
D . 反应至6min时,H2O2分解了50%
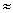
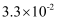 mol/(L·min)
B . 6~10min的平均反应速率:v(H2O2)<
mol/(L·min)
B . 6~10min的平均反应速率:v(H2O2)<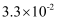 mol/(L·min)
C . 反应至6min时,c(H2O2)=0.3mol/L
D . 反应至6min时,H2O2分解了50%
mol/(L·min)
C . 反应至6min时,c(H2O2)=0.3mol/L
D . 反应至6min时,H2O2分解了50%
最近更新



